Rola sekretaz w chorobie Alzheimera
Sekretazy są enzymami proteolitycznymi odpowiedzialnymi za cięcie białek transbłonowych. Aktywność sekretaz ma kluczowe znaczenie w etiologii choroby Alzheimera, gdyż są one zaangażowane w cięcie białka prekursorowego amyloidu beta (APP). W warunkach fizjologicznych, nieamyloidogenne cięcie białka APP zachodzi przy udziale alfa i gamma sekretazy, podczas gdy w warunkach amyloidogennych białko APP jest cięte przez beta i gamma sekretazę. W przypadku fizjologicznego cięcia białka prekursorowego amyloidu beta, alfa sekretaza hydrolizuje łańcuch białka APP pomiędzy Lys687 i Leu688 w wyniku czego powstaje rozpuszczalna forma białka określana jako alfa-APPs oraz związany z błoną peptyd C83 o masie 10 kDa. Peptyd C83 jest następnie cięty przez gamma sekretazę w wyniku czego powstają dwa nietoksyczne peptydy P3 i P7 określane jako produkt CTF. Nieamyloidogenna droga przekształcania białka APP jest dominującą formą w komórkach i podlega jej około 90 % puli białka APP. W przypadku amyloidogennej drogi cięcia białka APP w pierwszym etapie beta sekretaza hydrolizuje APP pomiędzy Met671 a Asp672. Skutkiem działania beta sekretazy jest rozpuszczalne białko beta-APPs oraz związany z błoną peptyd C99 o masie 12 kDa. Peptyd C99 jest następnie hydrolizowany przez gamma sekretazę tworząc peptyd beta-amyloidu o masie 4 kDa oraz produkt CTF. Schematyczna ilustracja dwóch dróg przekształcania białka APP przy udziale sekretaz przedstawia rysunek 1.
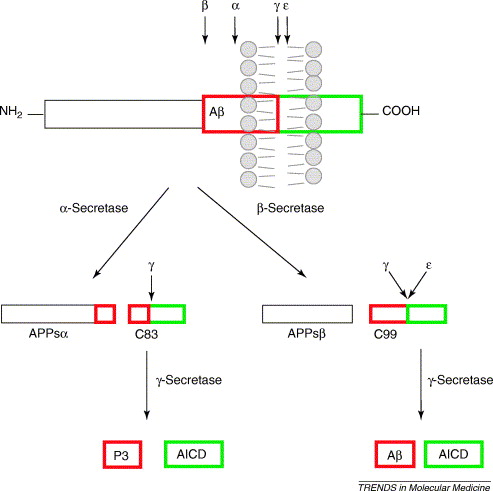
4 kDa amyloid beta (Abeta) jest białkiem złożonym z 39 lub 40 aminokwasów ale powstaje także pewna pula peptydu złożonego z 42 aminokwasów. Peptyd 42-aminokwasowy ma bardziej hydrofobowe właściwości niż krótsze formy Abeta, w związku z czym ma większe zdolności tworzenia agregatów typowych dla płytek starczych.
Literatura
- http://www.ptbun.org.pl/archiv/sw05_nawrot.pdf
- LaFerla F., Oddo S. Alzheimer’s disease: Ab, tau and synaptic dysfunction. Trends In Mol Med. 2005; 11:170-176.
- Cole S., Vassar R. The Alzheimer’s disease beta-secretase enzyme, BACE 1. Mol Neurodegeneration 2007; 2:22.