Opsyna w stanie aktywnym
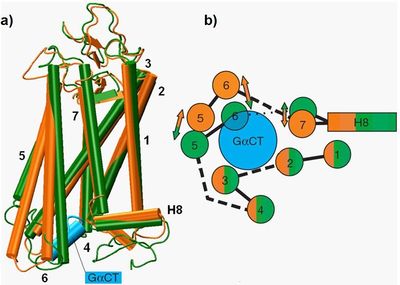
Dzięki postępom w metodach krystalograficznych, a w szczególności technice mikroogniskowania, w 2008 roku udało się skrystalizować opsynę (rodopsyna bez retinalu) [1] oraz uzyskać strukturę kompleksu opsyny z C-końcową częścią podjednostki α białka G (GαCT) [2]. Część podjednostki α białka G wnika w głąb rodopsyny i uczestniczy bezpośrednio w przeniesieniu sygnału z aktywnego receptora na białko G.
Absorpcja kwantu światła, powodująca izomeryzacę retinalu, prowadzi do zmian konformacyjnych w strukturze rodopsyny. Receptor przechodzi przez szereg stanów pośrednich (częściowo aktywnych), osiągając ostatecznie formę całkowicie aktywną (zwaną metarodopsyną II) [3], zdolną do wiązania białka G. Podczas tego procesu, zasada Schiffa ulega hydrolizie, co umożliwia oddysocjowanie całkowicie-trans-retinalu z miejsca wiązania w rodopsynie. Następnie, z udziałem izomerazy, uwolniony ligand zostaje przekształcony z powrotem do formy 11-cis. Cząsteczka opsyny wiąże się z 11-cis-retinalem, co inicjuje kolejny cykl aktywacyjny [4]. Aby jednak aktywna rodopsyna lub opsyna nie powodowała stałej aktywacji białek G, a w konsekwencji całej komórki pręcikowej, istnieje mechanizm wygaszania receptora. W pierwszej kolejności aktywna rodopsyna jest fosforylowana przez kinazę rodopsynową, a następnie do takiej rodopsyny przyłącza się arestyna. Ponieważ rodopsyna ulega oligomeryzacji sądzi się, że arestyna tworzy kompleks z dimerem rodopsyny [5, 6].
Opsyna jest niestabilna konformacyjnie i może istnieć zarówno w formie aktywnej jak i nieaktywnej (tzw. stan podstawowy). Wykazano, iż niska wartość pH oraz obecność GαCT (krótkich łańcuchów peptydowych, identycznych z C-końcową częścią podjednostki α białka G), dodatkowo stabilizują stan aktywny opsyny [7].
Porównując dwie struktury charakterystyczne dla stanu podstawowego rodopsyny (PDB ID: 1U19) [8] oraz formy aktywnej białka (PDB ID: 3DQB) [2], zaobserwować można duże zmiany w położeniu helis: TMH:V do TMH:VII. Natomiast struktura „rdzenia białka”, tworzona przez helisy: TMH:I do TMH:IV oraz położenie pętli zewnątrzkomórkowych EL:I do EL:III wraz z domeną N-końcową, są prawie niezmieniona (Rys. 1).
W strukturze opsyny część cytoplazmatyczna TMH:VI jest odchylona o 7 Å na zewnątrz białka [2]. Miejscem zgięcia helisy jest reszta TRP:6.48, której położenie w nieaktywnej strukturze rodopsyny jest stabilizowane przez związany 11-cis-retinal. W strukturze opsyny widocznym zmianom podlega również helisa TMH:V. Jest ona przesunięta w kierunku TMH:VI oraz wydłużona o trzy skręty helisy. Skutkuje to znacznym skróceniem pętli IL:III po stronie cytoplazmatycznej błony. Również połowa TMH:VII, zlokalizowana po wewnątrzkomórkowej stronie błony, jest przesunięta do środka receptora, co zmienia konformację części łańcucha łączącego ją z helisą VIII położoną prostopadle do błony. Różnice w lokalizacji poszczególnych helis wpływają na strukturę trzech pętli: IL:I do IL:III. Prowadzi to do zmiany kształtu powierzchni cytoplazmatycznej receptora w formie aktywnej, która jest interfejsem biorącym udział w wiązaniu białka G (transducyny).
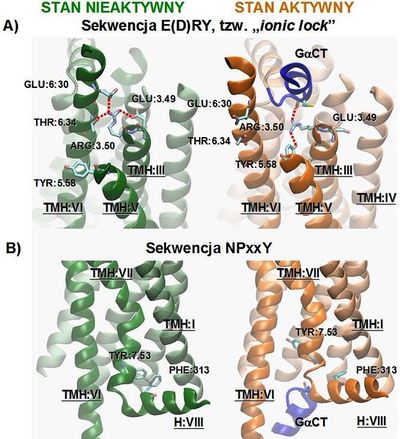
Przeprowadzenie rodopsyny ze stanu nieaktywnego do formy aktywnej (metarodopsyny II) wymaga zerwania oddziaływań wewnątrzcząsteczkowych odpowiedzialnych za stabilizację stanu podstawowego receptora. Kluczowe zmiany zachodzą wówczas w miejscu występowania dobrze zachowanych ewolucyjnie u wszystkich receptorów GPCR z rodziny A, motywów: E(D)RY, NPxxY (Rys. 2), w miejscu wiązania retinalu, jak i również w położeniu części cytoplazmatycznej helis: TMH:IV do TMH:VII [3, 9-12].
Sieć oddziaływań jonowych (tzw. ang. „ionic lock”) tworzona przez Arg:3.50 i Glu:3.49 z motywu E(D)RY (obecnego na TMH:III) oraz oddziałujące z nimi Glu:6.30 i Thr:6.34 z TMH:VI, stabilizuje wzajemne położenie dwóch helis [8]. Połączenie to zostaje jednak zerwane podczas aktywacji receptora na skutek ruchu TMH:VI. Zmiana położenia części cytoplazmatycznej TMH:V w stronę TMH:VII prowadzi do powstania wnęki po stronie wewnątrzkomórkowej opsyny, pozwalającej na wiązanie GαCT. Łańcuch boczny Arg:3.50 tworząc wiązanie wodorowe z Tyr:5.58, zmienia swoją orientację w kierunku wnętrza receptora. Pozwala to na bezpośrednie oddziaływanie naładowanego łańcucha bocznego Arg:3.50, z grupą karbonylową cysteiny obecnej na C-końcu wiązanej podjednostki GαCT. Dodatkowo, za stabilizację formy aktywnej receptora, jak i również powstałej wnęki, odpowiada Tyr:7.53 obecna w motywie NPxxY [2]. Pierścień Tyr:7.53 (która w stanie nieaktywnym oddziałuje z Phe:313 z helisy ósmej) skierowany do środka receptora, zapobiega zmianie położenia TMH:VI (Rys. 2).
Zobacz też
Literatura
- Park, J.H., et al., Crystal structure of the ligand-free G-protein-coupled receptor opsin. Nature, 2008. 454(7201): p. 183-7.
- Scheerer, P., et al., Crystal structure of opsin in its G-protein-interacting conformation. Nature, 2008. 455(7212): p. 497-502.
- Knierim, B., et al., Sequence of late molecular events in the activation of rhodopsin. Proc Natl Acad Sci U S A, 2007. 104(51): p. 20290-5.
- Okada, T., et al., Activation of rhodopsin: new insights from structural and biochemical studies. Trends Biochem Sci, 2001. 26(5): p. 318-24.
- Modzelewska, A., et al., Arrestin interaction with rhodopsin: conceptual models. Cell Biochem Biophys, 2006. 46(1): p. 1-15.
- Liang, Y., et al., Rhodopsin signaling and organization in heterozygote rhodopsin knockout mice. J Biol Chem, 2004. 279(46): p. 48189-96.
- Vogel, R. and F. Siebert, Conformations of the active and inactive states of opsin. J Biol Chem, 2001. 276(42): p. 38487-93.
- Okada, T., et al., The retinal conformation and its environment in rhodopsin in light of a new 2.2 A crystal structure. J Mol Biol, 2004. 342(2): p. 571-83.
- Fritze, O., et al., Role of the conserved NPxxY(x)5,6F motif in the rhodopsin ground state and during activation. Proc Natl Acad Sci U S A, 2003. 100(5): p. 2290-5.
- Grobner, G., et al., Observations of light-induced structural changes of retinal within rhodopsin. Nature, 2000. 405(6788): p. 810-3.
- Sheikh, S.P., et al., Rhodopsin activation blocked by metal-ion-binding sites linking transmembrane helices C and F. Nature, 1996. 383(6598): p. 347-50.
- Farrens, D.L., et al., Requirement of rigid-body motion of transmembrane helices for light activation of rhodopsin. Science, 1996. 274(5288): p. 768-70.