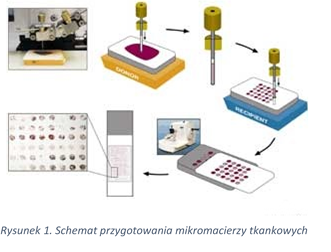
Mikromacierze tkankowe (TMA- Tissue Microarray)
Jest to technika coraz powszechniej stosowana w diagnostyce molekularnej. Pozwala na szybkie diagnozowanie wielu próbek jednocześnie, co znacznie zmniejsza koszty oraz czas wykonywania przy zachowaniu rzetelności wyników. Pozwala na diagnostykę markerów molekularnych zarówno na poziomie kwasów nukleinowych jak i białek. Podstawą do tworzenia mikromacierzy tkankowych jest wybór wcześniej pobranej tkanki donora, która znajduje się w parafinowym bloku i jest przetrzymywana w archiwach. Pobrana tkanka barwiona jest hematoksyliną oraz eozyną. Tak wybarwiona tkanka wyznacza tak zwany rdzeń TMA. Następnie przy pomocy odpowiedniego urządzenia (Beecher Instruments, San Prairie czy Wisconsin) niewielki fragment z rdzenia TMA zostaje wycięty i umiejscowiony we wcześniej wyciętej cylindrycznej studzience, o średnicy 0,6-2mm, o ściśle określonej pozycji na mikromacierzy (Rys.1.). Taki schemat powtarzany jest dla każdej próbki.
Wielką zaletą mikromacierzy tkankowych jest możliwość naniesienia na nie wielu próbek tkanek donorów (nawet do kilkuset). Ponadto, ze względu na to, że taka macierz to parafinowy blok, można wyciąć z niej wiele identycznych sekcji. Dzięki temu rzetelność uzyskanych wyników się zwiększa. Wśród zastosowań TMA znajdują się między innymi badania dotyczące nowotworów oraz ich progresji, diagnozowanie i prognozowanie markerów nowotworowych, oznaczania markerów terapeutycznych, charakteryzowania ekspresji genów oraz genów supresorowych. Ponadto technika ta ułatwia standaryzajcę metod immunohistochemicznego barwienia. Najczęściej stosowaną metodą diagnozowania jest barwienie immunohistochemiczne, ale używane są również takie techniki jak FISH czy fluorescencyjna lub mRNA hybrydyzacja in situ. Zaletami mikromacierzy tkankowych są między innymi możliwość szybkiego analizowania wielu próbek jednocześnie (nawet tej samej tkanki) przy zachowaniu statystycznej istotności wyników. Pozwalają na badanie zarówno tkanek, jak i kultur komórkowych. Ponieważ do odczytu płytek stosowane są odpowiednie urządzenia, redukuje się błędy powstałe przez subiektywną ocenę osoby prowadzącej badania. Stosowanie TMA zachowuje badaną tkankę co pozwala na jej dalszą analizę. Mimo wielu zalet tej metody istnieją pewne słabości. Stosowane próbki są utrwalane w formalinie, która chemicznie modyfikuje cząsteczki RNA zmieniając strukturę epitopową. Może to spowodować poważne błędy w analizie in situ. W przypadku pewnych nowotworów mały rozmiar badanych próbek jednocześnie okazuje się wadą, ponieważ nie jest w stanie zobrazować profilu całej tkanki, która często zawiera regiony apoptotyczne czy nekrotyczne.
Literatura
- Packeisen J, Korsching E, Herbst H, Boecker W, Buerger H: Demystified . . . Tissue microarray technology. Journal of Clinical Pathology 2003, 56:198–204.
- Singh AS, Sau AKS: Tissue Microarray: A powerful and rapidly evolving tool for high-throughput analysis of clinical specimens. International Journal of Case Reports and Images 2010, 01:1-6
- Shergill IS, Schergill NK, Arya M, Patel HRH. Tissue microarrays: A current medical research tool. Current Medical and Research Opinion 2004, 20(5):707-712.