Somatoliberyna
Hormon uwalniający hormon wzrostu (GHRH, z ang. growth hormone-releasing hormone) to neuropeptyd podwzgórzowy, który reguluje sekrecję hormonu wzrostu GH. Istnieją dwie formy somatoliberyny o podobnej funkcji biologicznej, składające się z 40 i 44 aminokwasów. Biologicznie aktywny jest N-końcowy fragment peptydu składający się z 29 aminokwasów. Białko prekursorowi GHRH ma długość 107 lub 108 aminokwasów i swoją strukturą nawiązuje do takich białek jak sekretyna, PACAP, GIP, glukagon i VIP. Poza podwzgórzem i przysadką somatoliberynę wykrywa się w łożysku, jajnikach, jądrach, trzustce, komórkach nerek, prostaty, sutka, grasicy, wątroby. Synteza GHRH odbywa się neuronach podwzgórzowych zlokalizowanych w jądrze łukowatym i brzuszno-bocznym. Uwolniona z aksonów somatoliberyna siecią naczyń wrotnych wraca do przysadki gruczołowej i łącząc się z receptorem GHRH-R na komórkach somatotropowych, pobudza syntezę i wydzielanie hormonu wzrostu. Poza stymulacją wydzielana GH, somatoliberyna jest odpowiedzialna za prawidłowy wzrost i różnicowanie się komórek somatotropowych przysadki. Wpływa również na procesy snu i czuwania. Uważa się, że może także oddziaływać na komórki układu odpornościowego, gdyż na niektórych ich typach zlokalizowano receptory GHRH-R, jednakże mechanizm ich działania nie jest znany.
Poza funkcją fizjologiczną, somatoliberyna ma duże znaczenie w procesach onkogenezy. Wiele typów komórek nowotworowych wykazuje ekspresję receptorów dla somatoliberyny. Wykazano, iż somatoliberyna pobudza proliferację komórek nowotworowych płuc, jajnika, trzustki, jelita grubego, żołądka, glejaka wielopostaciowego. Ponadto wpływa także na wydzielanie GH i insulinopodobnych czynników wzrostu, które także stymulują proces nowotworzenia.
Wydzielanie somatoliberyny jest regulowane na zasadzie sprzężenia zwrotnego na osi GHRH/GH/IGF-I. Zarówno GH jak i IGF-I hamują wydzielanie GHRH. Czynnikami regulującymi sekrecję GHRH są także neuroprzekaźniki układu nerwowego takie jak acetylocholina, noradrenalina, dopomina (działanie stymulujące) oraz GABA i noradrenalina (działanie hamujące). Z kolei somatostatyna, za pośrednictwem receptora SSTR2 hamuje wydzielanie GH i pośrednio moduluje wydzielanie GHRH. Innym czynnikiem regulującym wydzielanie GHRH, somatostatyny i GH jest ghrelina, peptyd produkowany głównie przez komórki żołądka i dwunastnicy. Ghrelina hamuje wydzielanie somatostatyny, a także jest odpowiedzialna za wzrost stężenia w surowicy krwi GH.
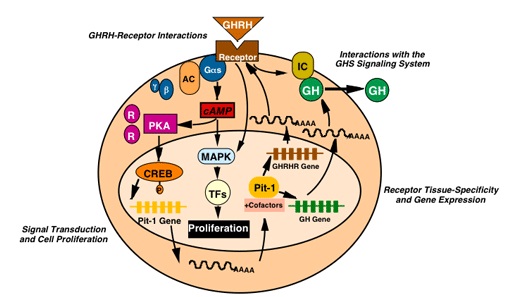
Sygnał indukowany przez somatoliberynę zapoczątkowuje aktywacja swoistego receptora GHRH-R. Jest on zbudowany z siedmiu domen śródbłonkowych, zewnątrzkomórkowego hydrofilnego odcinka wiążącego ligand i długiej domeny cytoplazmatycznej. Na powierzchni błony komórkowej receptor jest powiązany z kompleksem białka G (alfa, beta, gamma). Przyłączenie liganda indukuje wymianę związanego z podjednostką alfa GDP na GTP a następnie oderwanie tego kompleksu od receptora. W wyniku tego w komórce są obecne dwa aktywne kompleksy alfa-GTP i beta-gamma. Oddziałują one na białka efektorowe takie jak cykloza adenylanowa, fosfolipaza C. Cykloza adenylanowa katalizuje przekształcanie ATP w cAMP, który aktywuje kinazę PKA a ta z kolei aktywuje białka kanału wapniowego. W wyniku aktywacji kanałów wapniowych, jony napływają do komórki, co pobudza sekrecję GH z przysadki. Z kolei droga niezależna od cAMP, wiąże się z pobudzeniem białka G i fosfolipazy C, co zwiększa poziom IP3 i w konsekwencji także zwiększa pulę jonów wapnia w komórce. Zależna od GHRH proliferacja komórek odbywa się na drodze zależnej od szlaku Ras, Raf, MAPK. Szlaki komórkowe zależne od GHRH przedstawia schematycznie Rysunek 1.
Piśmiennictwo: