Ubikwitynacja
Proces potranslacyjnej modyfikacji białek polegający na połączeniu ubikwityny poprzez C-końcową glicynę z grupą aminową lizyny białka podlegającego modyfikacji.
Ubikwityna jest polipeptydem złożonym z 76 aminokwasów, o masie 8,5 kDa. Zidentyfikowano ją we wszystkich typach komórek i tkanek organizmów eukariotycznych. Białka komórkowe są modyfikowane poprzez dołączenie jednej (mono-) lub wielu (poliubikwitynacja) cząsteczek ubikwityny. Ubikwityna jest wysoce termostabilna, odporna na szeroki zakres pH i konserwatywna homologicznie. Ubikwityna drożdży ma tylko 3 różne aminokwasy od ludzkiej.
Proces ubikwitynacji u wszystkich Eukaryota jest procesem uniwersalnym, w wyniku którego białka komórkowe zostają naznaczone do degradacji. Białko komórkowe połączone z ubikwityną podlega degradacji z udziałem proteaz pozalizosomalnych w strukturach zwanych proteasomami. Degradacji zależnej od ubikwityny podlegają białka błędnie zsyntetyzowane, nieprawidłowo rozmieszczone w komórce lub starzejące się. Przebieg ubikwitynacji jest wieloetapowy, wymagającym zaangażowania wielu enzymów oraz energii pochodzącej z ATP. Co ważne, ubikwitynacja jest procesem nieodwracalnym. Naznaczone do degradacji białko nie może już zostać ochronione przez rozkładem.
Pierwszym etapem ubikiwtynacji jest połączenie ubikwityny w pozycji 48 (lizyna) substratu białkowego. Tylko takie połączenie umożliwia rozpoznanie kompleksu przez proteasom.
Ubikwityna jest aktywowana przez enzym E1 (ubiquitin activating enzyme – UBA) przy udziale energii z ATP. Reakcja transestryfikacji prowadzi do powstania wysokoenergetycznego wiązania pomiędzy glicyną na C-końcu ubikwityny a grupą –SH reszty cesteinowej w centrum enzymu E1. Produktem reakcji jest produkt pośredni E1-U. W kolejnym etapie, cząsteczka ubikwityny jest przenoszona na resztę cysternową enzymu koniugującego (ubiquitin conjugating enzyme – E2 –UBC), tworząc produkt E2-U. W końcowym etapie ligaza ubikwitynowa (ubiquitin ligase E3 – UBL) przenosi ubikwitynę na substrat białkowy z utworzeniem produktu U-NH2-białko. Działanie ligazy prowadzi do powstania wiązania izopeptydowego między aktywowanym c-końcem ubikwityny i –NH2 jednej z reszt lizenowych białka podlegającego modyfikacji. Proces powtarza się kilkukrotnie, aż białko ulegnie naznaczeniu do degradacji. Degradacja białka jest możliwa po przyłączenia co najmniej 4 reszt ubikwitynowych. Ubikwitynacji białka w pozycji Lys-48 lub Lys-29 prowadzi do rozpoznania takiego kompleksu przez proteasom 26S. Niektóre białka komórkowe wymagają w procesie ubikwitynacji dodatkowej obecności czynnika elongacji łańcucha (E4). Schematyczny przebieg procesu ubikwitynacji jest przedstawiony na rysunku 1.
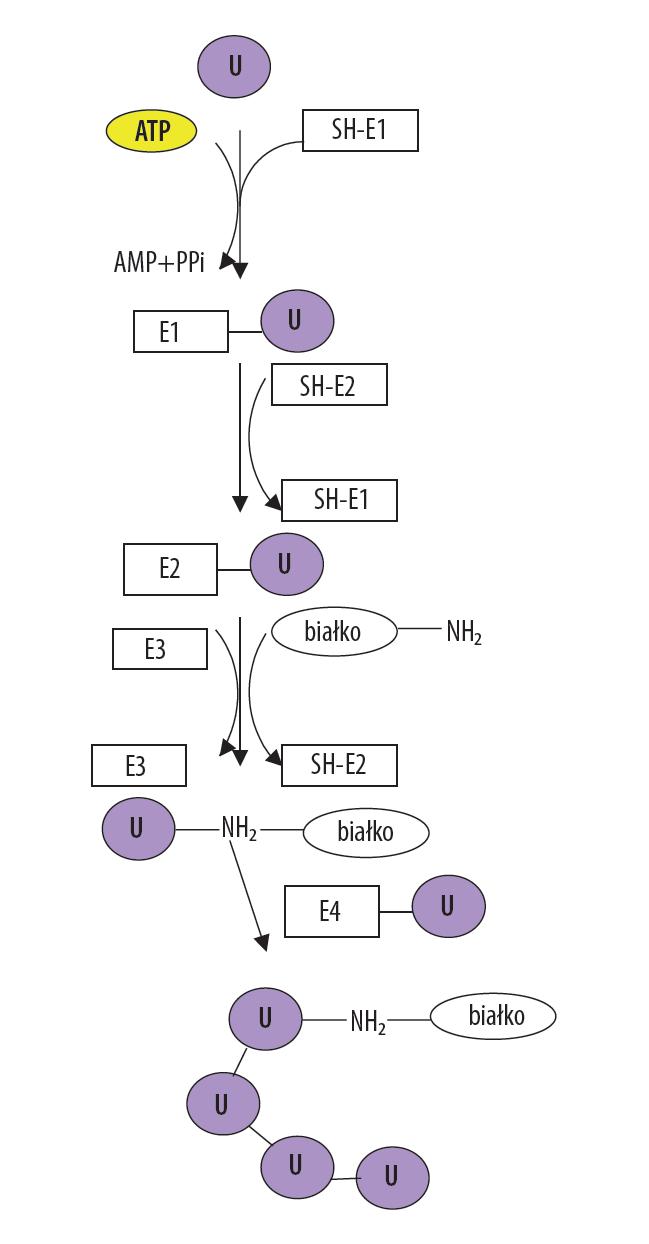
Regulacja procesu ubikwitynacji zachodzi przy udziale enzymów deubikwitynujących (DUB). Enzymy DUB hydrolizują łańcuchy ubikwityny, zarówno z uwolnionych proteasomów po degradacji białka, jak również te związane z białkami, które nie uległy jeszcze degradacji. W tym drugim przypadku, DUB pełnią funkcję ochronną opóźniając degradację białek, podczas gdy uwolniona ubikwityna może być kierowana do wtórnego obiegu i znakowania kolejnych białek.
Poza udziałem w degradacji białek, ubikwityna ma swój udział w komórkowej regulacji procesów transkrypcji, translokacji białek błonowych do kompartymentów endosomalnych. Ubikwityna zmienia bowiem strukturę histonów i ich wzajemne oddziaływania oraz oddziaływanie histonów z DNA. Tym samym rozluźnia strukturę DNA, co umożliwia ekspozycję rejonów paromotorowych genów i ekspresję informacji genetycznej. Rozluźnienie DNA umożliwia także procesy metylacji.
Piśmiennictwo: