| (Nie pokazano 3 pośrednich wersji utworzonych przez tego samego użytkownika) | |||
| Linia 1: | Linia 1: | ||
==RODZINA BIAŁEK SR== | ==RODZINA BIAŁEK SR== | ||
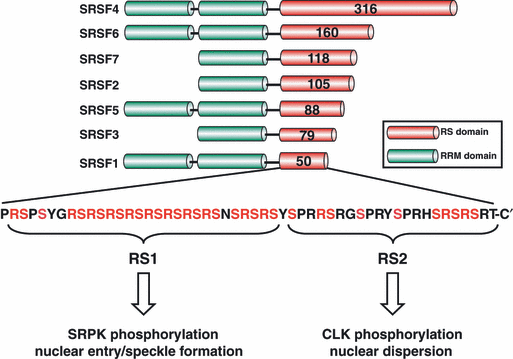
Białka SR swoją nazwę zawdzięczają wielokrotnemu powtórzeniu dipeptydu seryna (S) - arginina (R) w domenie zwanej domeną RS. O przynależności do tej rodziny nie decyduje tylko wystepowanie domeny RS w białku, ale również musi występować motyw rozpoznający RNA (RRM - z ang.: RNA Recognition Motif) (rys. 1.) lub alternatywnie motyw homologiczny do RRM (RRMH), który RNA nie rozpoznaje. Białka z tej rodziny biorą udział w takich procesach jak kostytutywny i alternatywny splicing pre-mRNA, translacja mRNA oraz w wielu procesach posttranskrypcyjnych np.: jądrowego eksportu mRNA. Tą uniwersalność umożliwia budowa tych białek, dzięki której mogą jednoczesnie oddziaływać z RNA jak i innymi białkami. | Białka SR swoją nazwę zawdzięczają wielokrotnemu powtórzeniu dipeptydu seryna (S) - arginina (R) w domenie zwanej domeną RS. O przynależności do tej rodziny nie decyduje tylko wystepowanie domeny RS w białku, ale również musi występować motyw rozpoznający RNA (RRM - z ang.: RNA Recognition Motif) (rys. 1.) lub alternatywnie motyw homologiczny do RRM (RRMH), który RNA nie rozpoznaje. Białka z tej rodziny biorą udział w takich procesach jak kostytutywny i alternatywny splicing pre-mRNA, translacja mRNA oraz w wielu procesach posttranskrypcyjnych np.: jądrowego eksportu mRNA. Tą uniwersalność umożliwia budowa tych białek, dzięki której mogą jednoczesnie oddziaływać z RNA jak i innymi białkami. | ||
| − | + | ||
| + | [[Image:FEBS_7992_f1.gif|thumb|center|800px| Rys. 1. Schemat ludzkich białek SR z zaznaczoną sekwencją aminokwasową domeny RS SRSF1 (źródło: http://onlinelibrary.wiley.com/doi/10.1111/j.1742-4658.2010.07992.x/full)]] | ||
'''WYSTĘPOWANIE BIAŁEK SR''' | '''WYSTĘPOWANIE BIAŁEK SR''' | ||
| Linia 9: | Linia 10: | ||
'''FOSFORYLACJA BIAŁEK SR''' | '''FOSFORYLACJA BIAŁEK SR''' | ||
| − | Fsforylacja i defosforylacja seryny w domenie RS białek SR odgrywa kluczową rolę w regulacji splicingu oraz może wpływać na lokalizację białek SR oraz na ich udział w translacji i transporcie mRNA z jądra komórkowego do cytoplazmy. Najlepszym przykładem takiego białka jest ludzkie SRSF1, ale nie tylko. Udowodniono, że oprócz w/w białka jeszcze ludzkie SRSF3 i SRSF7 przemieszczają się pomiędzy jadrem komórkowym a cytoplazmą. W tym celu łączą się z receptorem TAP/NFX1 w jądrze komórkowym, do czego niezbędna jest fosforylacja ich niektórych sern w domenie | + | Fsforylacja i defosforylacja seryny w domenie RS białek SR odgrywa kluczową rolę w regulacji splicingu oraz może wpływać na lokalizację białek SR oraz na ich udział w translacji i transporcie mRNA z jądra komórkowego do cytoplazmy. Najlepszym przykładem takiego białka jest ludzkie SRSF1, ale nie tylko. Udowodniono, że oprócz w/w białka jeszcze ludzkie SRSF3 i SRSF7 przemieszczają się pomiędzy jadrem komórkowym a cytoplazmą. W tym celu łączą się z receptorem TAP/NFX1 w jądrze komórkowym, do czego niezbędna jest fosforylacja ich niektórych sern w domenie RS [1]. |
| − | Znane są cztery rodziny kinaz, których członkowie fosforylują białka SR: | + | Znane są cztery rodziny kinaz, których członkowie fosforylują białka SR: SRPK [2], Clk/Sty [3], cdc2/p34 [4] i topoizomeraza I [5]. Przy czym w przypadku dwóch pierwszych znany jest szczególowoy mechanizm fosforylacji dla SRSF1. |
'''UDZIAŁ BIAŁEK SR W SPLICINGU''' | '''UDZIAŁ BIAŁEK SR W SPLICINGU''' | ||
| − | Funkcja jaką białka SR pełnią w splicingu można podzielić na tę zależną od eksonów i niezależną6. Funkcja zależna od eksonów widoczna jest podczas tworzenia kompleksu E, kiedy w procesie zwanym definiowaniem eksonów oddziałując z miejscem ESE (z ang.: exsonic splicing enhacer) na eksonie oraz U1 i U2 nRNP na sąsiednich intronach, udział białka SR uniemożliwia pominięcie eksonu. Mogą też hamować działanie inhibitorów w miejscach ESE na tym samym eksonie (inhibitory splicingu zachowują się odwrotnie od opisanego zachowania dla białek SR).Funkcją niezależną jest uczestnictwo w interakcjach pomiędzy białkowymi czynnikami splicingowymi. Najbardziej znane to organizacja kompleksu B i C w procesie splicingu, gdzie białka SR rekrutują kompleks U4/U6●U5 tri-snRNP do spliceosomu i umożliwiają przeprowadzenie wycięcia | + | Funkcja jaką białka SR pełnią w splicingu można podzielić na tę zależną od eksonów i niezależną6. Funkcja zależna od eksonów widoczna jest podczas tworzenia kompleksu E, kiedy w procesie zwanym definiowaniem eksonów oddziałując z miejscem ESE (z ang.: exsonic splicing enhacer) na eksonie oraz U1 i U2 nRNP na sąsiednich intronach, udział białka SR uniemożliwia pominięcie eksonu. Mogą też hamować działanie inhibitorów w miejscach ESE na tym samym eksonie (inhibitory splicingu zachowują się odwrotnie od opisanego zachowania dla białek SR).Funkcją niezależną jest uczestnictwo w interakcjach pomiędzy białkowymi czynnikami splicingowymi. Najbardziej znane to organizacja kompleksu B i C w procesie splicingu, gdzie białka SR rekrutują kompleks U4/U6●U5 tri-snRNP do spliceosomu i umożliwiają przeprowadzenie wycięcia intronu [6,7,8]. |
| − | Podczas alternatywnego splicingu porócz dwóch w/w funkcji dochodzi trzeci: rozpoznawanie suboptymalnych traktów pirymidynowych w intronach i wiązanie się do nich. Związanie białka SR do w/w sekwencji powoduje rekrutację czynnika splicingowego U2AF do położonego obok traktu pirymidynowego, który dla intronów oddznaczających się małym powinowactwem do U2AF jest niewidoczny. Brak takiego wiązania, powoduje nierozponanie końca 3’ intronu, a co za tym idzie rozpoznawany jest kolejny koniec 3’ i błędnie wycinamy dwa introny przedzielone | + | Podczas alternatywnego splicingu porócz dwóch w/w funkcji dochodzi trzeci: rozpoznawanie suboptymalnych traktów pirymidynowych w intronach i wiązanie się do nich. Związanie białka SR do w/w sekwencji powoduje rekrutację czynnika splicingowego U2AF do położonego obok traktu pirymidynowego, który dla intronów oddznaczających się małym powinowactwem do U2AF jest niewidoczny. Brak takiego wiązania, powoduje nierozponanie końca 3’ intronu, a co za tym idzie rozpoznawany jest kolejny koniec 3’ i błędnie wycinamy dwa introny przedzielone eksonem [6,7,8]. |
Przedstawione regulacje splicingu przez białka SR dotyczą tylko głównych mechanizmów ich działania, w rzeczywistości udział tych białk jest bardziej skomplikowany i zależny od fosforylacji. | Przedstawione regulacje splicingu przez białka SR dotyczą tylko głównych mechanizmów ich działania, w rzeczywistości udział tych białk jest bardziej skomplikowany i zależny od fosforylacji. | ||
Aktualna wersja na dzień 13:55, 27 sie 2013
RODZINA BIAŁEK SR
Białka SR swoją nazwę zawdzięczają wielokrotnemu powtórzeniu dipeptydu seryna (S) - arginina (R) w domenie zwanej domeną RS. O przynależności do tej rodziny nie decyduje tylko wystepowanie domeny RS w białku, ale również musi występować motyw rozpoznający RNA (RRM - z ang.: RNA Recognition Motif) (rys. 1.) lub alternatywnie motyw homologiczny do RRM (RRMH), który RNA nie rozpoznaje. Białka z tej rodziny biorą udział w takich procesach jak kostytutywny i alternatywny splicing pre-mRNA, translacja mRNA oraz w wielu procesach posttranskrypcyjnych np.: jądrowego eksportu mRNA. Tą uniwersalność umożliwia budowa tych białek, dzięki której mogą jednoczesnie oddziaływać z RNA jak i innymi białkami.
WYSTĘPOWANIE BIAŁEK SR
Białka z tej rodziny występują u wszystkich kręgowców i niektórych niższych eukaryota. Są obecne u drożdży rozszczepkowych (Schizosaccharomyces pombe), ale brak ich u drożdży pączkujących (Saccharomyces cerevisiae), które posiadają inne białka podobne do białek SR tzw. SR-like protein, które są zaangażowane w metabolizm pre-mRNA, a brak typowych białek SR u tych drożdży tłumaczy się brakiem alternatywnego splicinu (do tej pory nie został on zaobserwowany).
FOSFORYLACJA BIAŁEK SR
Fsforylacja i defosforylacja seryny w domenie RS białek SR odgrywa kluczową rolę w regulacji splicingu oraz może wpływać na lokalizację białek SR oraz na ich udział w translacji i transporcie mRNA z jądra komórkowego do cytoplazmy. Najlepszym przykładem takiego białka jest ludzkie SRSF1, ale nie tylko. Udowodniono, że oprócz w/w białka jeszcze ludzkie SRSF3 i SRSF7 przemieszczają się pomiędzy jadrem komórkowym a cytoplazmą. W tym celu łączą się z receptorem TAP/NFX1 w jądrze komórkowym, do czego niezbędna jest fosforylacja ich niektórych sern w domenie RS [1].
Znane są cztery rodziny kinaz, których członkowie fosforylują białka SR: SRPK [2], Clk/Sty [3], cdc2/p34 [4] i topoizomeraza I [5]. Przy czym w przypadku dwóch pierwszych znany jest szczególowoy mechanizm fosforylacji dla SRSF1.
UDZIAŁ BIAŁEK SR W SPLICINGU
Funkcja jaką białka SR pełnią w splicingu można podzielić na tę zależną od eksonów i niezależną6. Funkcja zależna od eksonów widoczna jest podczas tworzenia kompleksu E, kiedy w procesie zwanym definiowaniem eksonów oddziałując z miejscem ESE (z ang.: exsonic splicing enhacer) na eksonie oraz U1 i U2 nRNP na sąsiednich intronach, udział białka SR uniemożliwia pominięcie eksonu. Mogą też hamować działanie inhibitorów w miejscach ESE na tym samym eksonie (inhibitory splicingu zachowują się odwrotnie od opisanego zachowania dla białek SR).Funkcją niezależną jest uczestnictwo w interakcjach pomiędzy białkowymi czynnikami splicingowymi. Najbardziej znane to organizacja kompleksu B i C w procesie splicingu, gdzie białka SR rekrutują kompleks U4/U6●U5 tri-snRNP do spliceosomu i umożliwiają przeprowadzenie wycięcia intronu [6,7,8].
Podczas alternatywnego splicingu porócz dwóch w/w funkcji dochodzi trzeci: rozpoznawanie suboptymalnych traktów pirymidynowych w intronach i wiązanie się do nich. Związanie białka SR do w/w sekwencji powoduje rekrutację czynnika splicingowego U2AF do położonego obok traktu pirymidynowego, który dla intronów oddznaczających się małym powinowactwem do U2AF jest niewidoczny. Brak takiego wiązania, powoduje nierozponanie końca 3’ intronu, a co za tym idzie rozpoznawany jest kolejny koniec 3’ i błędnie wycinamy dwa introny przedzielone eksonem [6,7,8].
Przedstawione regulacje splicingu przez białka SR dotyczą tylko głównych mechanizmów ich działania, w rzeczywistości udział tych białk jest bardziej skomplikowany i zależny od fosforylacji.
BIBLIOGRAFIA
- Huang Y., Gattoni R., Stévenin J., Steitz J.A.,”SR splicing factors serve as adapter proteins for TAP-dependent mRNA export.” Mol Cell. 2003; 11 (3):837-843
- Mattaj I.W, ”RNA processing. Splicing in space” Nature, 1994;372:727-728
- Colwill K., Pawson T., Andrews B., Prasad J., Manley J.L., Bell J.C., Duncan P.I., ”The Clk/Sty protein kinase phosphorylates SR splicing factors and regulates their intranuclear distribution.” EMBO J, 1996;15:265-275
- Okamoto Y., Onogi H., Honda R., Yasuda H., Wakabayashi T., Nimura Y., Hagiwara M., ”Cdc2 kinase-mediated phosphorylation of splicing factor SF2/ASF.” Biochem Biophys Res Commun 1998;249:872-878
- Soret J., Tazi J., ”Phosphorylation-dependent control of the pre-mRNA splicing machinery.” Prog Mol Subcell Biol 2003;31:89-126
- Shepard P.J., Hertel K.J., ”The SR protein family.” Genome Biology 2009;10:242
- Graveley B.R., ”Sorting out the complexity of SR protein functions.” RNA 2000;6:1197-211
- Long J.C., Caceres J.F., ”The SR protein family of splicing factors: master regulators of gene expression.” Biochem J. 2009;1:15-27
- Ghosh G., Adams J.A., ”Phosphorylation mechanism and structure of serine-arginine protein kinases.” FEBS Journal 2011;278;4 (2): 587–597