(→Autofagia) |
(→Autofagia) |
||
| (Nie pokazano 4 pośrednich wersji utworzonych przez tego samego użytkownika) | |||
| Linia 1: | Linia 1: | ||
==Autofagia== | ==Autofagia== | ||
| − | Autofagia – inaczej autofagocytoza, to proces biologiczny polegający na kontrolowanym rozkładzie cząsteczek, fragmentów komórki, organelli komórkowych w celu pozyskania dodatkowego źródła energii. Autofagia jest procesem zachodzącym we wszystkich organizmach, od bakterii i drożdży począwszy na organizmie człowieka kończąc. Autofagia jest indukowana w komórkach w odpowiedzi na wiele czynników m.in. infekcje bakteryjne lub wirusowe, stres oksydacyjny, brak substancji odżywczych. Jest także niezbędnym narzędziem w procesach embriogenezy czy wymiany organelli komórkowych. Indukcję autofagii wykazano również w przebiegu procesów chorobowych, takich jak rak, choroby serca, choroba Crohna, miopatie, schorzenia wątroby, neurodegeneracja. Niektóre dane literaturowe wskazują na protekcyjne działanie autofagii, podczas gdy inni badacze wskazują na negatywne skutki jej udziału w procesie chorobowym. | + | '''Autofagia''' – inaczej autofagocytoza, to proces biologiczny polegający na kontrolowanym rozkładzie cząsteczek, fragmentów komórki, organelli komórkowych w celu pozyskania dodatkowego źródła energii. Autofagia jest procesem zachodzącym we wszystkich organizmach, od bakterii i drożdży począwszy na organizmie człowieka kończąc. Autofagia jest indukowana w komórkach w odpowiedzi na wiele czynników m.in. infekcje bakteryjne lub wirusowe, stres oksydacyjny, brak substancji odżywczych. Jest także niezbędnym narzędziem w procesach embriogenezy czy wymiany organelli komórkowych. Indukcję autofagii wykazano również w przebiegu procesów chorobowych, takich jak rak, choroby serca, choroba Crohna, miopatie, schorzenia wątroby, neurodegeneracja. Niektóre dane literaturowe wskazują na protekcyjne działanie autofagii, podczas gdy inni badacze wskazują na negatywne skutki jej udziału w procesie chorobowym. |
Wyróżniamy trzy rodzaje autofagii: mikroautofagię, autofagię związana z chaperonami (białkami opiekuńczymi) oraz makroautofagię. | Wyróżniamy trzy rodzaje autofagii: mikroautofagię, autofagię związana z chaperonami (białkami opiekuńczymi) oraz makroautofagię. | ||
| − | Makroautofagia jest najlepiej poznanym rodzajem autofagii. Można wyróżnić w jej przebiegu kolejne fazy, które podlegają regulacji pozytywnej lub negatywnej przez białka regulatorowe z rodziny Atg. Pierwszym etapem makroautofagii jest wyodrębnienie z ER błony odgraniczającej, która sekwestruje fragment cytoplazmy z organellami. Następnie błona odgraniczająca ulega wydłużenia i zamknięciu w pęcherzyk otoczony podwójną błoną zwany autofagosomem. Autofagosom ulega następnie fuzji z lizosomom lub późnym endosomem lub ciałkiem wielopęcherzykowym i ulega przekształceniu w autofagolizosom. W autofagolizosomie zawartość pęcherzyka ulega trawieniu przez enzymy lizosomalne a produkty rozkładu są wykorzystywane do syntezy de novo. Wśród białek regulujących przebieg autofagii wyróżniamy beklinę, która połączona z białkiem Bcl-2 zapobiega indukcji autofagii. Zmniejszenie liczby kompleksów beklina-Bcl-2 umożliwia inicjację autofagii. Markerem tworzących się autofagosomów jest z kolei białko MAPL-C3. Makroautofagia powoduje charakterystyczne zmiany w morfologii komórek, stąd jest najczęściej opisywanym rodzajem tego procesu. | + | Makroautofagia jest najlepiej poznanym rodzajem autofagii. Można wyróżnić w jej przebiegu kolejne fazy, które podlegają regulacji pozytywnej lub negatywnej przez białka regulatorowe z rodziny Atg. Pierwszym etapem makroautofagii jest wyodrębnienie z ER błony odgraniczającej, która sekwestruje fragment cytoplazmy z organellami. Następnie błona odgraniczająca ulega wydłużenia i zamknięciu w pęcherzyk otoczony podwójną błoną zwany autofagosomem. Autofagosom ulega następnie fuzji z lizosomom lub późnym endosomem lub ciałkiem wielopęcherzykowym i ulega przekształceniu w autofagolizosom. W autofagolizosomie zawartość pęcherzyka ulega trawieniu przez enzymy lizosomalne a produkty rozkładu są wykorzystywane do syntezy ''de novo''. Wśród białek regulujących przebieg autofagii wyróżniamy beklinę, która połączona z białkiem Bcl-2 zapobiega indukcji autofagii. Zmniejszenie liczby kompleksów beklina-Bcl-2 umożliwia inicjację autofagii. Markerem tworzących się autofagosomów jest z kolei białko MAPL-C3. Makroautofagia powoduje charakterystyczne zmiany w morfologii komórek, stąd jest najczęściej opisywanym rodzajem tego procesu. |
| − | Mikroautofagia polega na sekwestrowaniu molekuł lub fragmentów komórki do lizosomów, poprzez wgłębienie błony lizosomalnej i zamknięcie zawartości w pęcherzyku przemieszczanym do wnętrza organellum. Z kolei autofagia związana z chaperonami polega na proteosomalnej degradacji białka naznaczonego wiązaniem z białkiem HSC70. Białko przeznaczone do rozkładu jest transportowane do błony lizosomy, gdzie łączy się z białkiem receptorowym LAMP2 a następnie zostaje przetransportowane do wnętrza lizosomy, w którym ulega proteolitycznej degradacji. Schematyczna ilustracja procesów autofagii jest przedstawiona na rysunku 1 | + | Mikroautofagia polega na sekwestrowaniu molekuł lub fragmentów komórki do lizosomów, poprzez wgłębienie błony lizosomalnej i zamknięcie zawartości w pęcherzyku przemieszczanym do wnętrza organellum. Z kolei autofagia związana z chaperonami polega na proteosomalnej degradacji białka naznaczonego wiązaniem z białkiem HSC70. Białko przeznaczone do rozkładu jest transportowane do błony lizosomy, gdzie łączy się z białkiem receptorowym LAMP2 a następnie zostaje przetransportowane do wnętrza lizosomy, w którym ulega proteolitycznej degradacji. Schematyczna ilustracja procesów autofagii jest przedstawiona na rysunku 1. |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | [[Image:rys1bp.jpg|thumb|center|700px| Rys. 1. (źródło: http://www.nature.com/cr/journal/v22/n1/fig_tab/cr2011152f1.html)]] | ||
| + | Autofagia jest mechanizmem uruchamianym pierwotnie w celu ochrony komórki i jej przetrwania w warunkach niekorzystnych. Przykładem, jest indukcja autofagii w przebiegu chorób neurodegeneracyjnych, których podłożem jest kumulacja wadliwych białek lub prionów na terenie cytoplazmy komórki. Przykładem jest choroba Alzeimer’a. W odpowiedzi na gromadzenie się w komórkach patogennego amyloidu beta, indukowana jest autofagia jako pierwotne narzędzie usuwania złogów białkowych. Ilustrację tego procesu przedstawia rysunek 2. | ||
| + | [[Image:rys2bp.jpg|thumb|center|700px| Rys. 2. (źródło: http://www.mit.edu/~sarkar/Research.html)]] | ||
W przebiegu chorób nowotworowych, autofagii przypisuje się przeciwstawne w skutkach, z punktu widzenia terapeutycznego, funkcje. Jest to głównie uwarunkowane stadium rozwoju guza. Autofagia może warunkować przetrwanie guza podczas pierwotnej fazy jego wzrostu, kiedy następuje zwiększenie liczby komórek bez dostępu do naczyń krwionośnych. W komórkach znajdujących się w rdzeniu masy guza proces autofagii pozwala na przetrwanie okresu zubożonego dostępu do substancji odżywczych zawartych we krwi. Po etapie unaczynienia guza, autofagia jest indukowana w odpowiedzi na chemioterapię i pozwala na usuwanie np. uszkodzonych mitochondriów, zmniejszając lub całkowicie uniemożliwiając działanie leków. Należy jednak pamiętać, iż długotrwały przebieg autofagii może prowadzić do śmierci komórki, stąd indukcja tego procesu w komórkach nowotworowych może być także sojusznikiem w walce z chorobą. | W przebiegu chorób nowotworowych, autofagii przypisuje się przeciwstawne w skutkach, z punktu widzenia terapeutycznego, funkcje. Jest to głównie uwarunkowane stadium rozwoju guza. Autofagia może warunkować przetrwanie guza podczas pierwotnej fazy jego wzrostu, kiedy następuje zwiększenie liczby komórek bez dostępu do naczyń krwionośnych. W komórkach znajdujących się w rdzeniu masy guza proces autofagii pozwala na przetrwanie okresu zubożonego dostępu do substancji odżywczych zawartych we krwi. Po etapie unaczynienia guza, autofagia jest indukowana w odpowiedzi na chemioterapię i pozwala na usuwanie np. uszkodzonych mitochondriów, zmniejszając lub całkowicie uniemożliwiając działanie leków. Należy jednak pamiętać, iż długotrwały przebieg autofagii może prowadzić do śmierci komórki, stąd indukcja tego procesu w komórkach nowotworowych może być także sojusznikiem w walce z chorobą. | ||
Aktualna wersja na dzień 13:43, 5 cze 2012
Autofagia
Autofagia – inaczej autofagocytoza, to proces biologiczny polegający na kontrolowanym rozkładzie cząsteczek, fragmentów komórki, organelli komórkowych w celu pozyskania dodatkowego źródła energii. Autofagia jest procesem zachodzącym we wszystkich organizmach, od bakterii i drożdży począwszy na organizmie człowieka kończąc. Autofagia jest indukowana w komórkach w odpowiedzi na wiele czynników m.in. infekcje bakteryjne lub wirusowe, stres oksydacyjny, brak substancji odżywczych. Jest także niezbędnym narzędziem w procesach embriogenezy czy wymiany organelli komórkowych. Indukcję autofagii wykazano również w przebiegu procesów chorobowych, takich jak rak, choroby serca, choroba Crohna, miopatie, schorzenia wątroby, neurodegeneracja. Niektóre dane literaturowe wskazują na protekcyjne działanie autofagii, podczas gdy inni badacze wskazują na negatywne skutki jej udziału w procesie chorobowym.
Wyróżniamy trzy rodzaje autofagii: mikroautofagię, autofagię związana z chaperonami (białkami opiekuńczymi) oraz makroautofagię.
Makroautofagia jest najlepiej poznanym rodzajem autofagii. Można wyróżnić w jej przebiegu kolejne fazy, które podlegają regulacji pozytywnej lub negatywnej przez białka regulatorowe z rodziny Atg. Pierwszym etapem makroautofagii jest wyodrębnienie z ER błony odgraniczającej, która sekwestruje fragment cytoplazmy z organellami. Następnie błona odgraniczająca ulega wydłużenia i zamknięciu w pęcherzyk otoczony podwójną błoną zwany autofagosomem. Autofagosom ulega następnie fuzji z lizosomom lub późnym endosomem lub ciałkiem wielopęcherzykowym i ulega przekształceniu w autofagolizosom. W autofagolizosomie zawartość pęcherzyka ulega trawieniu przez enzymy lizosomalne a produkty rozkładu są wykorzystywane do syntezy de novo. Wśród białek regulujących przebieg autofagii wyróżniamy beklinę, która połączona z białkiem Bcl-2 zapobiega indukcji autofagii. Zmniejszenie liczby kompleksów beklina-Bcl-2 umożliwia inicjację autofagii. Markerem tworzących się autofagosomów jest z kolei białko MAPL-C3. Makroautofagia powoduje charakterystyczne zmiany w morfologii komórek, stąd jest najczęściej opisywanym rodzajem tego procesu. Mikroautofagia polega na sekwestrowaniu molekuł lub fragmentów komórki do lizosomów, poprzez wgłębienie błony lizosomalnej i zamknięcie zawartości w pęcherzyku przemieszczanym do wnętrza organellum. Z kolei autofagia związana z chaperonami polega na proteosomalnej degradacji białka naznaczonego wiązaniem z białkiem HSC70. Białko przeznaczone do rozkładu jest transportowane do błony lizosomy, gdzie łączy się z białkiem receptorowym LAMP2 a następnie zostaje przetransportowane do wnętrza lizosomy, w którym ulega proteolitycznej degradacji. Schematyczna ilustracja procesów autofagii jest przedstawiona na rysunku 1.
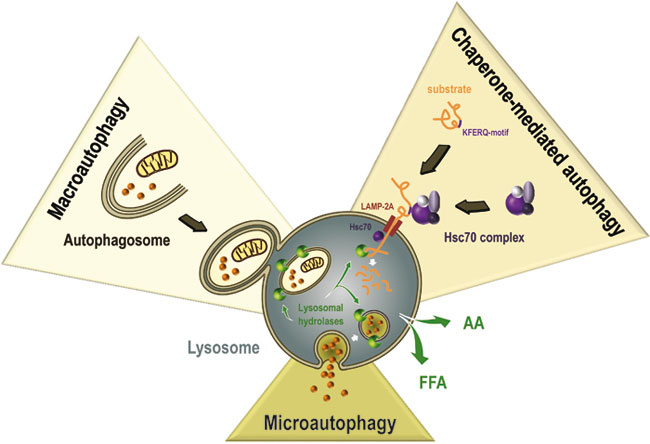
Autofagia jest mechanizmem uruchamianym pierwotnie w celu ochrony komórki i jej przetrwania w warunkach niekorzystnych. Przykładem, jest indukcja autofagii w przebiegu chorób neurodegeneracyjnych, których podłożem jest kumulacja wadliwych białek lub prionów na terenie cytoplazmy komórki. Przykładem jest choroba Alzeimer’a. W odpowiedzi na gromadzenie się w komórkach patogennego amyloidu beta, indukowana jest autofagia jako pierwotne narzędzie usuwania złogów białkowych. Ilustrację tego procesu przedstawia rysunek 2.
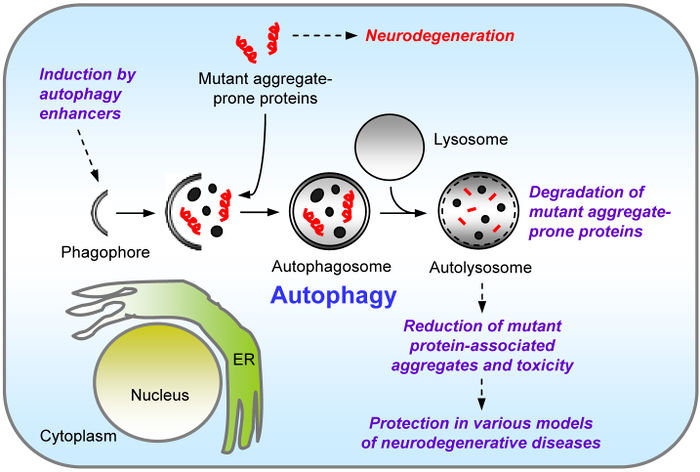
W przebiegu chorób nowotworowych, autofagii przypisuje się przeciwstawne w skutkach, z punktu widzenia terapeutycznego, funkcje. Jest to głównie uwarunkowane stadium rozwoju guza. Autofagia może warunkować przetrwanie guza podczas pierwotnej fazy jego wzrostu, kiedy następuje zwiększenie liczby komórek bez dostępu do naczyń krwionośnych. W komórkach znajdujących się w rdzeniu masy guza proces autofagii pozwala na przetrwanie okresu zubożonego dostępu do substancji odżywczych zawartych we krwi. Po etapie unaczynienia guza, autofagia jest indukowana w odpowiedzi na chemioterapię i pozwala na usuwanie np. uszkodzonych mitochondriów, zmniejszając lub całkowicie uniemożliwiając działanie leków. Należy jednak pamiętać, iż długotrwały przebieg autofagii może prowadzić do śmierci komórki, stąd indukcja tego procesu w komórkach nowotworowych może być także sojusznikiem w walce z chorobą.
Literatura
- Dumit V, Dengiel J. Autophagosomal protein dynamice and influenza virus infection. Front Immunol 2012; 43.
- Zhou S, Kuang M, Zhang B, Zhao L, Liang Z, Yi T, Huang C, Zhao X, Wei Y. Autophagy In tumorigenesis and cancer therapy: Dr. Jekyll or Mr. Hyde? Cancer Lett. 2012; 25.
- Rosello A, Warnes G, Meier UC. Cell death pathways and autophagy in the central nervous system and its involvement in neurodegeneration, immunity and central nervous system infection: to die or not to die that is the question. Clin Exp Immunol 2012; 168: 52-7.
- Kundu M, Thompson CB. Autophagy: basic principles and relevance to disease. Ann. Rev Pathol 2008; 3: 427-55.
- Pattingre S, Espert L, Biard-Piechaczyk M, Codogno P. Regulation of macroautophagy by mTOR and beclin-1 complexes. Biochimie 2008; 90: 313-23.
- Yang YP, Liang ZQ, Gu ZL, Qin ZH. Molecular mechanism and regulation of autophagy. Acta Pharmacol Sin. 2005; 26: 1421-34.