(→Kinaza JAK2) |
(→Kinaza JAK2) |
||
| Linia 28: | Linia 28: | ||
'''Znaczenie kinazy JAK2 w chorobach mieloproliferacyjnych''' | '''Znaczenie kinazy JAK2 w chorobach mieloproliferacyjnych''' | ||
---- | ---- | ||
| − | Mutacje substytucyjne oraz translokacje chromosomalne onkogennej kinazy JAK2 w chorobach proliferacyjnych krwi | + | . |
| + | |||
| + | {|class="wikitable center" | ||
| + | |+Mutacje substytucyjne oraz translokacje chromosomalne onkogennej kinazy JAK2 w chorobach proliferacyjnych krwi | ||
| + | ! Lp. | ||
| + | ! onkogen JAK2 | ||
| + | ! choroba hematologiczna | ||
| + | ! literatura | ||
| + | |- | ||
| + | | 1 | ||
| + | | JAK2V617F | ||
| + | | czerwienica prawdziwa (choroba Vasqueza) | ||
| + | | Baxter et al. 2005 | ||
| + | |- | ||
| + | |rowspan=2 | ||
| + | |rowspan=2 | ||
| + | | nadpłytkowość samoistna i pierwotna mielofibroza | ||
| + | | Lerine et al. 2005 | ||
| + | |- | ||
| + | | 2 | ||
| + | | JAK2L611S | ||
| + | | ostra białaczka limfoblastyczna | ||
| + | | Funakoski-Tago et al. 2009 | ||
| + | |- | ||
| + | | 3 | ||
| + | | JAK2K607N | ||
| + | | ostra białaczka szpikowa | ||
| + | | Lee et al. 2006 | ||
| + | |- | ||
| + | | 4 | ||
| + | | JAK2D620E | ||
| + | | nieklasyfikowalny syndrom mieloproliferacyjny | ||
| + | | Schnittger et al. 2006 | ||
| + | |- | ||
| + | | 5 | ||
| + | | JAK2ΔIREED | ||
| + | | ostra białaczka limfoblastyczna komórek prekursorowych B | ||
| + | | Malinge et al. 2007 | ||
| + | |- | ||
| + | | 6 | ||
| + | | JAK2T875N | ||
| + | | ostra białaczka megakarioblastyczna | ||
| + | | Mercher et al. 2006 | ||
| + | |- | ||
| + | | 7 | ||
| + | | TEL-JAK2 | ||
| + | | ostra białaczka limfoblastyczna | ||
| + | | Lacronique et al. 2000 | ||
| + | | atypowa przewlekła białaczka szpikowa | ||
| + | | Saharinen et al. 2003 | ||
| + | |- | ||
| + | | 8 | ||
| + | | PCM1-JAK2 | ||
| + | | chłoniaki T-komórkowe | ||
| + | | Reiter et al. 2005, Adelaide et al. 2006 | ||
| + | | atypowa przewlekła białaczka szpikowa | ||
| + | | Bosquet et al. 2005 | ||
| + | | ostra białaczka erytrocytarna | ||
| + | | Murati et al. 2005 | ||
| + | |- | ||
| + | | 9 | ||
| + | | BCR-JAK2 | ||
| + | | atypowa ostra białaczka limfoidalna | ||
| + | | Griesinger et al. 2005 | ||
| + | | typowa przewlekła białaczka szpikowa | ||
| + | | Griesinger et al. 2005 | ||
| + | | ostra białaczka szpikowa | ||
| + | | Cirmena et al. 2008 | ||
| + | |- | ||
| + | | 10 | ||
| + | | RPN1-JAK2 | ||
| + | | przewlekła idiopatyczna mielofibroza (zwłóknienie szpiku) | ||
| + | | Mark et al. 2006 | ||
| + | |- | ||
| + | | 11 | ||
| + | | SSBP2-JAK2 | ||
| + | | ostra białaczka limfocytarna komórek prekursorowych B | ||
| + | | Poitras et al. 2008 | ||
| + | |} | ||
| + | |||
| + | Mutacje somatyczne w genie jak2 można podzielić na dwie grupy: mutacje punktowe lub kilkuaminokwasowe delecje w wąskim obszarze domeny pseudokinazowej (pozycje 1-6), a także translokacje chromosomalne prowadzące do powstania kinaz fuzyjnych (pozycje 7-11). Mutacje w domenie pseudokatalitycznej znoszą hamujący wpływ tej domeny na domenę katalityczną kinazy, w rezultacie powodując jej nadaktywność. Natomiast dość sporym zaskoczeniem była identyfikacja mutacji punktowej w domenie katalitycznej (pozycja 6). Z kolei w wypadku translokacji chromosomalnych powstają tzw. fuzyjne kinazy JAK2 (FTK, ang. fusion tyrosine kinase, Wilks 2008). Partnerem fuzyjnym C-końcowej części kinazy JAK2 są białka zdolne do oligomeryzacji, co umożliwia autofosforylację kinazy JAK2. | ||
Wersja z 22:03, 12 maj 2014
Kinaza JAK2
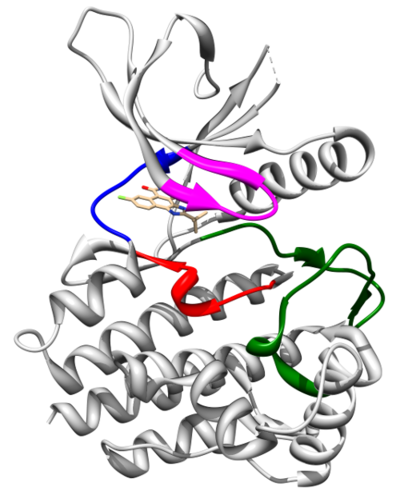
Kinaza JAK2 należy do rodziny niereceptorowych tyrozynowych kinaz białkowych JAK. Kinaza ta jest częścią ścieżek sygnalnych JAK2/STAT3/5 (Signal Transducer and Activator of Transcription) i uczestniczy w transdukcji sygnałów zewnątrzkomórkowych za pośrednictwem cytokin, czynników wzrostu i hormonów. Ma typową dla białek JAK czterodomenową budowę - od C-końca można wyróżnić następujące domeny: JH1, JH2, SH2 oraz FERM. Domena JH1 (aminokwasy 835 do 1132, PubMed NM 004972) kinazy JAK2 jest typową dla komórek eukariotycznych domeną katalityczną o aktywności kinazy tyrozynowej (PTK - Protein Tyrosine Kinase). Spełnia ona trzy kluczowe role: wiązanie i pozycjonowanie donora reszty fosforanowej (ATP, GTP) w kompleksie z dwuwartościowymi kationami (Mg2+, Mn2+), wiązanie i pozycjonowanie substratu peptydowego, a także transfer γ-fosforanu na aminokwas akceptorowy.
Pierwsza poznana struktura domeny kinazowej JAK2 to struktura krystalograficzna kompleksu tej domeny z inhibitorem CMP6 (Lucet et al. 2006). Ma ona typową dla kinaz dwupłatową budowę z płatem N-terminalnym (aminokwasy 840-931) oraz C-terminalnym (932-1132). Pierwszy płat jest złożony z pięciu antyrównoległych wstążek beta i jednej helisy alfa (αC). Drugi natomiast jest zbudowany z ośmiu helis alfa (αD-αK) i trzech par antyrównoległych wstążek beta (β7-β8, β6-β9, β10-β11). Centrum aktywne, wraz z miejscem wiązania cząsteczki ATP, znajduje się w kieszeni pomiędzy płatami, które połączone są tzw. rejonem zawiasowym. W wiązaniu substratów reakcji fosforylacji: cząsteczki ATP oraz białka uczestniczy również pętla aktywacyjna (aminokwasy 994-1024). Autofosforylacja tyrozyn 1007 oraz 1008 działa jak molekularny przełącznik aktywności fosforylacyjnej kinazy JAK2. W wyniku autofosforylacji Tyr1007 oraz Tyr1008 dochodzi do otwarcia pętli aktywacyjnej i przesunięcia motywu DFG (aminokwasy 994-996), oddziałującego z jonami Mg2+, w pobliże centrum aktywnego. Autofosforylacja umożliwia ponadto wiązanie wielu białek regulatorowych, jak SOCS czy PTP. Pętla insercyjna (aminokwasy 1056-1078), charakterystyczna dla wszystkich domen kinazowych JAK, przypuszczalnie zaangażowana jest w regulację fosforylacji tych białek.
| fragment struktury | aminokwasy | struktura kompleksu domeny kinazowej JAK2 z inhibitorem CMP6 (kod PDB: 2B7A) |
|---|---|---|
| rejon zawiasowy | 929-935 (MEYLPYG) |
|
| pętla glicynowa | 856-861 (GKGNFG) | |
| pętla katalityczna (motyw PTK – Protein Tyrosine Kinase Active-site Signature) | 972-984 (YIHRDLATRNILV) | |
| pętla aktywacyjna (z motywami DFG (994-996) i APE (1022-1024) oraz autofosforylowaną parą tyrozyn Y1007/Y1008) | 994-1024 (DFGLTKVLPQDKEYY KVKEPGESPIFWYAPE) |
Znaczenie kinazy JAK2 w chorobach mieloproliferacyjnych
.
| Lp. | onkogen JAK2 | choroba hematologiczna | literatura | ||||
|---|---|---|---|---|---|---|---|
| 1 | JAK2V617F | czerwienica prawdziwa (choroba Vasqueza) | Baxter et al. 2005 | ||||
| rowspan=2 | rowspan=2 | nadpłytkowość samoistna i pierwotna mielofibroza | Lerine et al. 2005 | ||||
| 2 | JAK2L611S | ostra białaczka limfoblastyczna | Funakoski-Tago et al. 2009 | ||||
| 3 | JAK2K607N | ostra białaczka szpikowa | Lee et al. 2006 | ||||
| 4 | JAK2D620E | nieklasyfikowalny syndrom mieloproliferacyjny | Schnittger et al. 2006 | ||||
| 5 | JAK2ΔIREED | ostra białaczka limfoblastyczna komórek prekursorowych B | Malinge et al. 2007 | ||||
| 6 | JAK2T875N | ostra białaczka megakarioblastyczna | Mercher et al. 2006 | ||||
| 7 | TEL-JAK2 | ostra białaczka limfoblastyczna | Lacronique et al. 2000 | atypowa przewlekła białaczka szpikowa | Saharinen et al. 2003 | ||
| 8 | PCM1-JAK2 | chłoniaki T-komórkowe | Reiter et al. 2005, Adelaide et al. 2006 | atypowa przewlekła białaczka szpikowa | Bosquet et al. 2005 | ostra białaczka erytrocytarna | Murati et al. 2005 |
| 9 | BCR-JAK2 | atypowa ostra białaczka limfoidalna | Griesinger et al. 2005 | typowa przewlekła białaczka szpikowa | Griesinger et al. 2005 | ostra białaczka szpikowa | Cirmena et al. 2008 |
| 10 | RPN1-JAK2 | przewlekła idiopatyczna mielofibroza (zwłóknienie szpiku) | Mark et al. 2006 | ||||
| 11 | SSBP2-JAK2 | ostra białaczka limfocytarna komórek prekursorowych B | Poitras et al. 2008 |
Mutacje somatyczne w genie jak2 można podzielić na dwie grupy: mutacje punktowe lub kilkuaminokwasowe delecje w wąskim obszarze domeny pseudokinazowej (pozycje 1-6), a także translokacje chromosomalne prowadzące do powstania kinaz fuzyjnych (pozycje 7-11). Mutacje w domenie pseudokatalitycznej znoszą hamujący wpływ tej domeny na domenę katalityczną kinazy, w rezultacie powodując jej nadaktywność. Natomiast dość sporym zaskoczeniem była identyfikacja mutacji punktowej w domenie katalitycznej (pozycja 6). Z kolei w wypadku translokacji chromosomalnych powstają tzw. fuzyjne kinazy JAK2 (FTK, ang. fusion tyrosine kinase, Wilks 2008). Partnerem fuzyjnym C-końcowej części kinazy JAK2 są białka zdolne do oligomeryzacji, co umożliwia autofosforylację kinazy JAK2.