Spis treści
- 1 Wstęp
- 2 Przygotowanie receptora oraz liganda
- 3 Instalacja programu AutoDock oraz ADT (AutoDockTools)
- 4 Wczytanie struktury receptora i liganda
- 5 Obliczenie siatki potencjałów z zastosowaniem procedury AutoGrid
- 6 Dokowanie liganda z wykorzystaniem procedury AutoDock
- 7 Analiza otrzymanych wyników
- 8 Porównanie otrzymanych wyników ze strukturą krystaliczną
Wstęp
Celem ćwiczenia jest zbadanie sposobów wiązania się carazololu (typowego antagonisty receptorów adrenergicznych) do receptora β2-adrenergiczneg z zastosowaniem programu AutoDock. Receptory adrenergiczne, podobnie jak rodopsyna, należą do rodziny A receptorów GPCR. Receptory te zlokalizowane są w dużej liczbie tkanek i narządów człowieka, między innymi w centralnym układzie nerwowym, wątrobie, trzustce, nerkach, płytkach krwi i w oku. Typowymi endogennymi ligandami tych białek są hormony, takie jak adrenalina (epinefryna) oraz noradrenalina (norepinefryna). Receptory adrenergiczne biorą udział w kaskadach sygnalizacyjnych: regulujących poziom ciśnienia tętniczego, odpowiadających za częstość skurczów serca, wpływających na funkcje oddechowe oraz mobilizację organizmu do obrony. Receptory adrenergiczne dzielimy na dwa typy α i β. Ponadto w każdej z rodzin, występuje kilka podtypów danego receptora, które różnią się między sobą lokalizacją w organizmie, selektywnością w wiązaniu ligandów, a także sposobem przekazywania sygnału przez białka G.
Poniższe ćwiczenie pokazuje od strony praktycznej jak do miejsca wiążącego białka można zadokować ligand korzystając z progarmu AutoDock oraz pakietu ADT (AutoDockTools). Szczegółowe informacje na temat metod wykorzystywanych w programach AutoDock oraz AutoGrid można znaleźć tutaj.
Przygotowanie receptora oraz liganda
Strukturę receptora pobrać można z bazy PDB (ang. Protein Data Bank), PDB ID: 2RH1. W pobranym pliku 2RH1.pdb oprócz innych cząsteczek zapisana jest struktura przestrzenna receptora β2-adrenergicznego.
- Strukturę samego receptora należy zachować w osobnym pliku receptor.pdb (reszty od ASP29 do LEU342)
- Współrzedne liganda (do pobrania: ligand) należ zachować w pliku ligand.pdb
Instalacja programu AutoDock oraz ADT (AutoDockTools)
- Program AutoDock należy pobrać ze strony: http://autodock.scripps.edu/downloads a następnie zainstalować go zgodnie z instrukcją
- Program ADT należy pobrać ze strony: http://autodock.scripps.edu/downloads/resources/adt/index_html a następnie zainstalować go zgodnie z instrukcją.
Wczytanie struktury receptora i liganda
- Należy stworzyć folder (np.: .\dokowanie) w którym będziemy przechowywać wszystkie pliki wymagane przez program AutoDock i ADT a następnie przekopiować tam nasze dwa pliki receptor.pdb oraz ligand.pdb.
- Uruchom program ADT umożliwiający przygotowanie wszystkich potrzebnych plików do programów autogrid4.exe oraz autodock4.exe
- W programie ADT określ folder w którym będą przechowywane wszystkie pliki:
- File > Preferences > Modify Defaults (następnie określ lokalizację stworzonego katalogu z plikami np.: C:\dokowanie)
- Wczytaj strukturę liganda:
- Ligand > Input > Open > ligand.pdb
- Dodaj polarne wodory do liganda. W tym celu należy najpierw zmienić typ atomu azotu znajdującego się w sąsiedztwie grupy –OH liganda:
- Edit > Atoms > Edit Type > (tu należy kliknąć na atom azotu i zmienić jego typ z „Npl” na „N3+”)
- Następnie dodaj polarne wodory:
- Edit > Hydrogens > Add > Polar Only
- Zachowaj strukturę liganda z dodanymi wodorami:
- File > Save > Write PDB > (zachowaj jako ligand_h.pdb)
- Skasuj ligand:
- Edit > Delete > Delete All Molecules
- Wczytaj strukturę ligand z dodanymi wodorami:
- Ligand > Input > Open > ligand_h.pdb
- Określ wiązania ruchome liganda:
- Ligand > Torsion Tree > Detect Root
- Zapisz ligand w formacie *.pdbqt:
- Ligand > Output > Save as PDBQT > ligand.pdbqt
- Wczytanie receptora:
- File > Read Macromolecule > receptor.pdb
- Dodaj polarne wodory do receptora:
- Edit > Hydrogens > Add > Polar Only
- Następnie zapisz receptor w formacie PDBQT:
- Flexible Residues > Chose Macromolecule > receptor.pdb
- File > Save > Write PDBQT > receptor.pdbqt
- Edit > Delete > Delete All Molecules
Obliczenie siatki potencjałów z zastosowaniem procedury AutoGrid
AutoGrid tworzy trójwymiarową siatkę obejmującą obszar miejsca wiążącego białka. Następnie, atom próbkujący umieszczany jest w każdym węźle siatki. Energia oddziaływania danego atomu z białkiem jest zapisywana kolejno na każdym węźle siatki. Procedura powtarzana jest dla każdego z typów atomów obecnych w ligandzie. W ten sposób tworzone są siatki potencjałów dla wszystkich typów atomów liganda, siatka potencjałów elektrostatycznych oraz siatka potencjałów opisująca energię desolwatacji. Tak otrzymane mapy potencjałów są następnie wykorzystywane przez program AutoDock do oszacowania energii wiązania liganda
- Wczytaj strukturę receptora i liganda w formacie PDBQT:
- Grid > Macromolecule > Open > receptor.pdbqt
- Grid > Set Map Types > Open Ligand > ligand.pdbqt
- Określ dla jakich typów atomów będą liczone siatki:
- Grid > Set Map Types > Directly > Accept
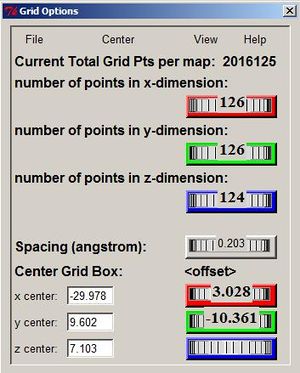
- Zdefiniuj położenie i rozmiar siatki. Miejsce wiązania ligandów w receptorach GPCR znajduje się we wnęce między helisami. Należy tak dobrać parametry siatki aby pokrywała ona całe miejsce wiążące receptora. Nie zapomnij zachować parametrów siatki w oknie Grid Options:
- Grid Box > (przykładowe parametry siatki widoczne na obrazku).
- File > Close saving current
- Zachowaj plik GPF.gpf:
- Grid > Output > Save GPF > GPF.gpf
- Uruchom program AutoGrid:
- Run > Run AutoGrid > (określ katalog w którym znajdują się wszystkie pliki oraz katalog w którym został zainstalowany program AutoGrid4.exe)
PRZYKŁADOWE PARAMETRY DO PROGRAMU AUTOGRID:
npts 126 126 124 # num.grid points in xyz gridfld receptor.maps.fld # grid_data_file spacing 0.197222222222 # spacing(A) receptor_types A C HD N OA SA # receptor atom types ligand_types A C OA HD N # ligand atom types receptor receptor.pdbqt # macromolecule gridcenter -29.978 9.602 7.103 # xyz-coordinates or auto smooth 0.5 # store minimum energy w/in rad(A) map receptor.A.map # atom-specific affinity map map receptor.C.map # atom-specific affinity map map receptor.OA.map # atom-specific affinity map map receptor.HD.map # atom-specific affinity map map receptor.N.map # atom-specific affinity map elecmap receptor.e.map # electrostatic potential map dsolvmap receptor.d.map # desolvation potential map dielectric -0.1465 # <0, AD4 distance-dep.diel;>0, constant
Dokowanie liganda z wykorzystaniem procedury AutoDock
Aby wykonać dokowanie z zastosowaniem procedury AutoDock należy przygotować plik DPF.dpf z parametrami określającymi procedurę dokowania.
- Określ strukturę receptora:
- Docking > Macromolecule > Set Rigid Filename > receptor.pdbqt
- Określ strukturę liganda:
- Docking > Choose > ligand > Accept
- Zapisz plik DPF.dpf:
- Docking > Output > Lamarckian GA > DPF.dpf
- Zadokuj ligand korzystając z procedury AutoDock:
- Run > Run AutoDock > (określ katalog w którym znajdują się wszystkie pliki oraz katalog w którym został zainstalowany program AutoDock4.exe)
PRZYKŁADOWE PARAMETRY DO PROGRAMU AUTODOCK:
autodock_parameter_version 4.2 # used by autodock to validate parameter set outlev 1 # diagnostic output level intelec # calculate internal electrostatics seed pid time # seeds for random generator ligand_types A C OA HD N # atoms types in ligand fld receptor.maps.fld # grid_data_file map receptor.A.map # atom-specific affinity map map receptor.C.map # atom-specific affinity map map receptor.OA.map # atom-specific affinity map map receptor.HD.map # atom-specific affinity map map receptor.N.map # atom-specific affinity map elecmap receptor.e.map # electrostatics map desolvmap receptor.d.map # desolvation map move ligand.pdbqt # small molecule about -29.8396 9.3008 7.0263 # small molecule center tran0 random # initial coordinates/A or random axisangle0 random # initial orientation dihe0 random # initial dihedrals (relative) or random tstep 2.0 # translation step/A qstep 50.0 # quaternion step/deg dstep 50.0 # torsion step/deg torsdof 7 # torsional degrees of freedom rmstol 2.0 # cluster_tolerance/A extnrg 1000.0 # external grid energy e0max 0.0 10000 # max initial energy; max number of retries ga_pop_size 150 # number of individuals in population ga_num_evals 25000000 # maximum number of energy evaluations ga_num_generations 27000 # maximum number of generations ga_elitism 1 # number of top individuals to survive to next generation ga_mutation_rate 0.02 # rate of gene mutation ga_crossover_rate 0.8 # rate of crossover ga_window_size 10 # ga_cauchy_alpha 0.0 # Alpha parameter of Cauchy distribution ga_cauchy_beta 1.0 # Beta parameter Cauchy distribution set_ga # set the above parameters for GA or LGA sw_max_its 300 # iterations of Solis & Wets local search sw_max_succ 4 # consecutive successes before changing rho sw_max_fail 4 # consecutive failures before changing rho sw_rho 1.0 # size of local search space to sample sw_lb_rho 0.01 # lower bound on rho ls_search_freq 0.06 # probability of performing local search on individual set_psw1 # set the above pseudo-Solis & Wets parameters unbound_model bound # state of unbound ligand ga_run 100 # do this many hybrid GA-LS runs analysis # perform a ranked cluster analysis
Analiza otrzymanych wyników
Program ADT zapewnia narzędzia do wizualizacji oraz wstępnej analizy otrzymanych wyników.
- Wczytaj konformacje zadokowanych ligandów:
- Analyze > Dockings > Open (otwórz plik DPF.dlg zawierający konformacje zadokowanego liganda)
- Wczytaj cząsteczkę białka:
- Analyze > Macromolecule > Open > receptor.pdbqt
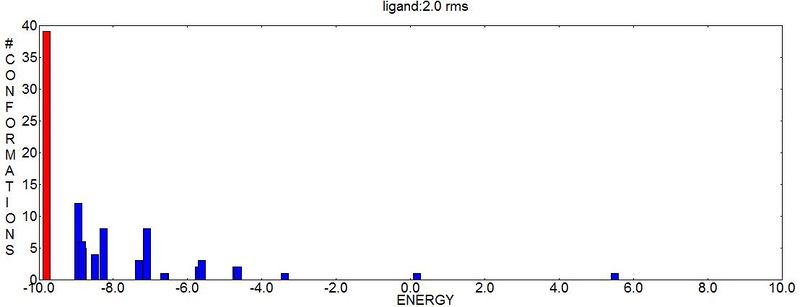
- Procedura AutoDock podczas dokowania liganda wykonała również wstępne klastrowanie 100 otrzymanych konformacji liganda. Są one zapisane pod koniec pliku DPF.dlg:
________________________________________________________________________________
Number of distinct conformational clusters found = 18, out of 100 runs,
Using an rmsd-tolerance of 2.0 A
CLUSTERING HISTOGRAM
____________________
________________________________________________________________________________
| | | | |
Clus | Lowest | Run | Mean | Num | Histogram
-ter | Binding | | Binding | in |
Rank | Energy | | Energy | Clus| 5 10 15 20 25 30 35
_____|___________|_____|___________|_____|____:____|____:____|____:____|____:___
1 | -9.79 | 84 | -8.95 | 39 |#######################################
2 | -8.95 | 65 | -7.64 | 12 |############
3 | -8.85 | 35 | -8.02 | 6 |######
4 | -8.82 | 41 | -7.96 | 5 |#####
5 | -8.50 | 40 | -7.22 | 4 |####
6 | -8.26 | 4 | -7.38 | 8 |########
7 | -7.30 | 10 | -7.15 | 3 |###
8 | -7.10 | 45 | -6.72 | 8 |########
9 | -6.62 | 2 | -6.62 | 1 |#
10 | -6.61 | 75 | -6.61 | 1 |#
11 | -5.70 | 86 | -5.52 | 2 |##
12 | -5.62 | 63 | -5.62 | 1 |#
13 | -5.61 | 7 | -5.57 | 3 |###
14 | -4.69 | 16 | -4.50 | 2 |##
15 | -4.64 | 17 | -3.62 | 2 |##
16 | -3.38 | 26 | -3.38 | 1 |#
17 | +0.18 | 53 | +0.18 | 1 |#
18 | +5.50 | 98 | +5.50 | 1 |#
_____|___________|_____|___________|_____|______________________________________
Otrzymane wyniki klastrowania można również wyświetlić w formie graficznej:
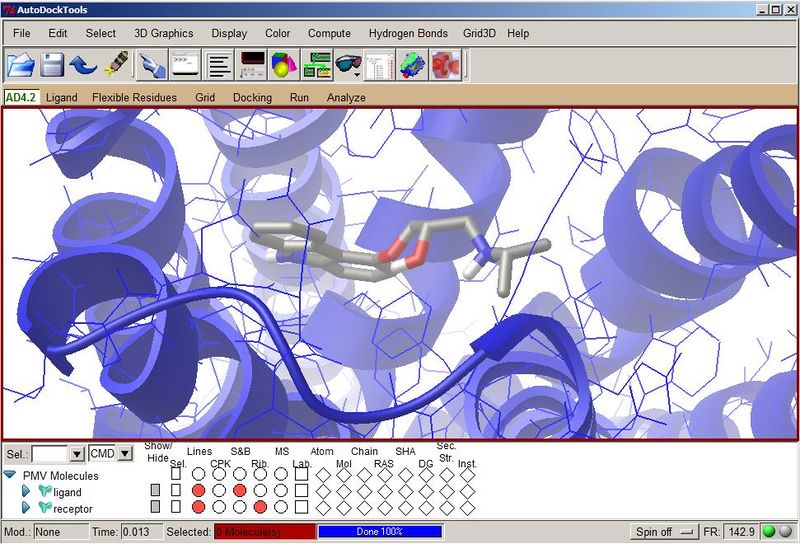
- Analyze > Clusterings > Show - klikając na dowolny słupek na wykresie, w oknie ADT można wyświetlić daną konformację liganda:
Istnieje również możliwość wyświetlenia wszystkich otrzymanych konformacji zadokowanego liganda: Analyze > Conformations > Play)
Porównanie otrzymanych wyników ze strukturą krystaliczną
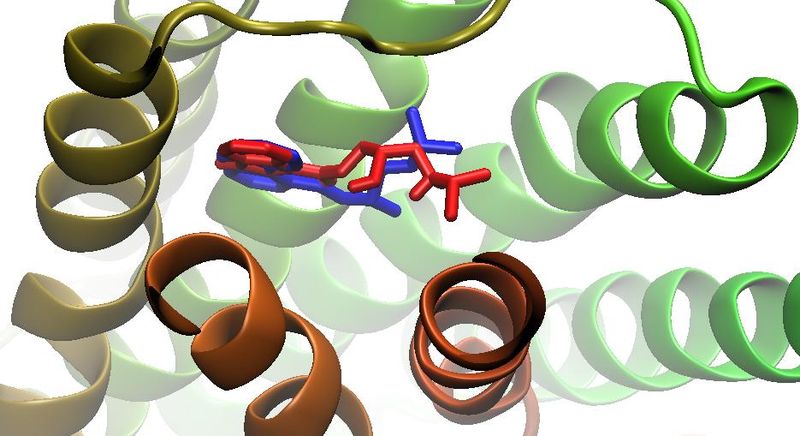
W bazie PDB dostępna jest struktura krystaliczna receptora β2-adrenergiczneg w kompleksie z carazololem (PDB ID: 2RH1). Po nałożeniu na siebie konformacji carazololu reprezentatywnej dla najwiekszego klastra oraz struktury krystalicznej widać, że program AutoDock prawidłowo przewidział przybliżone położenie i konformację wiązanego liganda.