Kinaza JAK2
Kinaza JAK2 należy do rodziny niereceptorowych tyrozynowych kinaz białkowych JAK. Kinaza ta jest częścią ścieżek sygnalnych JAK2/STAT3/5 (Signal Transducer and Activator of Transcription) i uczestniczy w transdukcji sygnałów zewnątrzkomórkowych za pośrednictwem cytokin, czynników wzrostu i hormonów. Ma typową dla białek JAK czterodomenową budowę - od C-końca można wyróżnić następujące domeny: JH1, JH2, SH2 oraz FERM. Domena JH1 (aminokwasy 835 do 1132, PubMed NM 004972) kinazy JAK2 jest typową dla komórek eukariotycznych domeną katalityczną o aktywności kinazy tyrozynowej (PTK - Protein Tyrosine Kinase). Spełnia ona trzy kluczowe role: wiązanie i pozycjonowanie donora reszty fosforanowej (ATP, GTP) w kompleksie z dwuwartościowymi kationami (Mg2+, Mn2+), wiązanie i pozycjonowanie substratu peptydowego, a także transfer γ-fosforanu na aminokwas akceptorowy.
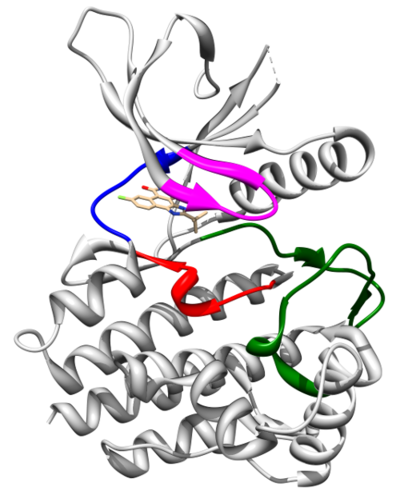
Pierwsza poznana struktura domeny kinazowej JAK2 to struktura krystalograficzna kompleksu tej domeny z inhibitorem CMP6 (Lucet et al. 2006). Ma ona typową dla kinaz dwupłatową budowę z płatem N-terminalnym (aminokwasy 840-931) oraz C-terminalnym (932-1132). Pierwszy płat jest złożony z pięciu antyrównoległych wstążek beta i jednej helisy alfa (αC). Drugi natomiast jest zbudowany z ośmiu helis alfa (αD-αK) i trzech par antyrównoległych wstążek beta (β7-β8, β6-β9, β10-β11). Centrum aktywne, wraz z miejscem wiązania cząsteczki ATP, znajduje się w kieszeni pomiędzy płatami, które połączone są tzw. rejonem zawiasowym. W wiązaniu substratów reakcji fosforylacji: cząsteczki ATP oraz białka uczestniczy również pętla aktywacyjna (aminokwasy 994-1024). Autofosforylacja tyrozyn 1007 oraz 1008 działa jak molekularny przełącznik aktywności fosforylacyjnej kinazy JAK2. W wyniku autofosforylacji Tyr1007 oraz Tyr1008 dochodzi do otwarcia pętli aktywacyjnej i przesunięcia motywu DFG (aminokwasy 994-996), oddziałującego z jonami Mg2+, w pobliże centrum aktywnego. Autofosforylacja umożliwia ponadto wiązanie wielu białek regulatorowych, jak SOCS czy PTP. Pętla insercyjna (aminokwasy 1056-1078), charakterystyczna dla wszystkich domen kinazowych JAK, przypuszczalnie zaangażowana jest w regulację fosforylacji tych białek.
| fragment struktury | aminokwasy | struktura kompleksu domeny kinazowej JAK2 z inhibitorem CMP6 (kod PDB: 2B7A) |
|---|---|---|
| rejon zawiasowy | 929-935 (MEYLPYG) |
|
| pętla glicynowa | 856-861 (GKGNFG) | |
| pętla katalityczna (motyw PTK – Protein Tyrosine Kinase Active-site Signature) | 972-984 (YIHRDLATRNILV) | |
| pętla aktywacyjna (z motywami DFG (994-996) i APE (1022-1024) oraz autofosforylowaną parą tyrozyn Y1007/Y1008) | 994-1024 (DFGLTKVLPQDKEYY KVKEPGESPIFWYAPE) |
Znaczenie kliniczne kinazy JAK2
| Lp. | onkogen JAK2 | choroba hematologiczna | literatura |
|---|---|---|---|
| 1 | JAK2V617F | czerwienica prawdziwa (choroba Vasqueza) | Baxter et al. 2005 |
| nadpłytkowość samoistna i pierwotna mielofibroza | Lerine et al. 2005 | ||
| 2 | JAK2L611S | ostra białaczka limfoblastyczna | Funakoski-Tago et al. 2009 |
| 3 | JAK2K607N | ostra białaczka szpikowa | Lee et al. 2006 |
| 4 | JAK2D620E | nieklasyfikowalny syndrom mieloproliferacyjny | Schnittger et al. 2006 |
| 5 | JAK2ΔIREED | ostra białaczka limfoblastyczna komórek prekursorowych B | Malinge et al. 2007 |
| 6 | JAK2T875N | ostra białaczka megakarioblastyczna | Mercher et al. 2006 |
| 7 | TEL-JAK2 | ostra białaczka limfoblastyczna | Lacronique et al. 2000 |
| atypowa przewlekła białaczka szpikowa | Saharinen et al. 2003 | ||
| 8 | PCM1-JAK2 | chłoniaki T-komórkowe | Reiter et al. 2005, Adelaide et al. 2006 |
| atypowa przewlekła białaczka szpikowa | Bosquet et al. 2005 | ||
| ostra białaczka erytrocytarna | Murati et al. 2005 | ||
| 9 | BCR-JAK2 | atypowa ostra białaczka limfoidalna | Griesinger et al. 2005 |
| typowa przewlekła białaczka szpikowa | Griesinger et al. 2005 | ||
| ostra białaczka szpikowa | Cirmena et al. 2008 | ||
| 10 | RPN1-JAK2 | przewlekła idiopatyczna mielofibroza (zwłóknienie szpiku) | Mark et al. 2006 |
| 11 | SSBP2-JAK2 | ostra białaczka limfocytarna komórek prekursorowych B | Poitras et al. 2008 |
Mutacje somatyczne w genie jak2 podzielić można na dwie grupy:
- mutacje punktowe lub kilkuaminokwasowe delecje w wąskim obszarze domeny pseudokinazowej,
- translokacje chromosomalne prowadzące do powstania kinaz fuzyjnych.
Mutacje w domenie pseudokinazowej znoszą hamujący wpływ tej domeny na domenę katalityczną kinazy, w rezultacie powodując jej "nadaktywność". W wypadku translokacji chromosomalnych powstają tzw. tyrozynowe kinazy fuzyjne JAK2 (FTK - Fusion Tyrosine Kinase, Wilks 2008). Partnerem fuzyjnym C-końcowej części kinazy JAK2 są białka zdolne do oligomeryzacji. Umożliwia to autofosforylację kinazy JAK2 niezależną od aktywacji i dimeryzacji receptora transmembranowego.
Związki niskocząsteczkowe zdolne do hamowania aktywności katalitycznej kinazy JAK2 - inhibitory kinazy JAK2 są potencjalnymi lekami przeciwnowotworowymi. Obecnie są one intensywnie rozwijane głównie przez firmy farmaceutyczne na całym świecie. Istniejące już inhibitory są w większości współzawodnicze i blokują wiązanie cząsteczki ATP w centrum aktywnym domeny kinazowej JAK2. Należą do różnych klas azaheterocykli takich, jak np.: pirymidyny, pirydyny, benzimidazole, nikotynonitryle czy azaindole. Współczynniki IC50 lub stałe inhibicji wielu z tych związków osiąga niskie wartości nanomolarne lub też subnanomolarne. Niestety cechą tych inhibitorów kinazy JAK2 jest ograniczona selektywność działania ze względu na wysoki stopień konserowowania kieszeni wiążącej ATP. Obecnie wysiłki firm faramceutycznych zmierzają nie tyle do zwiększenia siły inhibitorów kinazy JAK2, ale poprawy ich selektywności działania. Obecnie około 10 inhibitorów kinazy JAK2 znajduje się różnych etapach testów klinicznych (Tabela 2). Są one potencjalnymi lekami na choroby mieloproliferacyjne z onkogenami JAK2. Jeden z inhibitorów kinaz JAK (INCB018424, ruxolitinib) został zatwierdzony przez Amerykańską Agencję ds Żywności i Leków (FDA) jako lek (pod nazwą JAKAFI) przeciwko zwłóknieniu szpiku (zarówno mielofibrozie pierwotnej, jak i wtórnej).