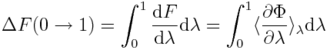Spis treści
Energia swobodna (projektowanie leków)
Wiązanie białko-ligand - często modelowany pierwszy etap komputerowo-wspomaganego projektowania leków - wydaje się być prostym zjawiskiem asocjacji dwóch cząsteczek. Ważne jest, aby zdać sobie sprawę dlaczego nie jesteśmy jeszcze w stanie "projektować" leków tak jak mosty czy samochody. We wszystkich tych przypadkach (projektowanie leków, mosty, samochody), opis fizyczny jest znany. Niestety, dokładność wymagana przy obliczaniu energii swobodnej wiązania liganda jest zaskakująco wysoka - co najmniej 1 kcal/mol (choć właściwie dokładność poniżej 0,5 kcal/mol odpowiadałaby dokładności eksperymentalnej, a zatem - być może - wymaganej przez biologię). Taka dokładność, o ile w ogóle możliwa, jest ekstremalnie trudna do uzyskania. Gdyby udało się odnaleźć metodę o takiej dokładności, bylibyśmy świadkami rewolucji w projektowaniu leków.
Jednakże dokładność nie jest jedynym celem motod wyznaczania energii swobodnej. Drugim ważnym celem jest koszt obliczeniowy. Poszukując potencjalnych inhibitorów pośród 100000 cząsteczek nie możemy sobie pozwolić na obliczenia trwające nawet 1 godzinę/ligand. Tu stajemy przed problemem: czy doskonalić dokładność metod wyznaczania energii swobodnej? Czy poświęcić dokładność na rzecz przeszukiwania większych zbiorów potencjalnych leków?
W tym artykule przedstawimy kilka przykładów zastosowania metod wyznaczania energii swobodnej. Wszystkie opisać można jako "niekowalencyjne wiązanie dwóch biocząsteczek". Rys. 1. przedstawia konstrukcję cyklu termodynamicznego często wykorzystywanego w tego typu problemach. W zależności od przejść zmiany energii swobodnej są łatwiej, bądź trudniej wyznaczane. (Słowo "łatwy" oznacza tutaj: dający lepszą dokładność przy niższych nakładach obliczeniowych.) Każdy przykład zawiera odniesienia do prac, które stanowią dobry wstęp do danej tematyki.
Wiązanie białko-ligand
Ogólne zasady wykorzystywane przy analizie wiązań białko-ligand znaleźć można w [1]. W wielu przypadkach koncentrujemy się na różnicach energi swobodnej wiązania między zestawem ligandów i/lub białek-mutantów. Podobnie jak w eksperymencie, metody komputerowe potrzebują ścisłej definicji odwracalnej przemiany między stanem początkowym i końcowym. Zmiany energii swobodnej w przejściach poziomych na Rys. 1. można wyznaczyć, przykładowo, wykorzystując całkowanie termodynamiczne (TI):
gdzie energia potencjalna, Φ, zależy od parametru λ, a nawiasy kątowe oznaczają średnią po zespole odpowiadającym Φ(λ), tzn. po konfiguracjach uzyskanych z symulacji z wykorzystaniem Φ(λ). Różnice w energii swobodnej wiązania można też uzyskać z transformacji poziomych (Rys. 1.), jednakże tego typu symulacje byłyby bardziej kosztowne obliczeniowo i trudniejsze do skonstruowania. Ale niezależnie od metody i wybranej drogi, metody obliczniowe pozwalają szacować różnice energii swobodnej.
Metody komputerowe mają jednak dwie podstawowe wady. Po pierwsze, są - trzeba przyznać - dość zawiłe (o czym świadczyć mogą chociażby artykuły w tym wiki), wymagają wiedzy eksperckiej i dużego doświadczenia. Po drugie, nie interesują nas tylko stany końcowe (ligand związany / ligand wolny), ale faktyczna ścieżka łącząca te dwa stany. Aby wiedzieć którędy wiedzie droga, musimy zapostulować coś o wielowymiarowej przestrzeni konfiguracyjnej generowanej przez badany układ. Tu pojawia się ryzyko narzucenia niewydajnego, bądź (co gosza) błędnego mechanizmu przejścia.
Dobre podsumowanie metod stosowanych w problemie wiązania białko-ligand znaleźć można w [2,3,4].
Rozpoznawanie i asocjacja: podążanie wzdłuż współrzędnej reakcji
Badanie procesu rozpoznawania i asocjacji wiąże się z określeniem parametru porządku, który jednoznacznie nakreśla sposób, w jaki dwa związki zbliżają się do siebie. W celu zrozumienia tych zjawisk potrzebujemy określić zmiany energii swobodnej wzdłuż tego parametru porządku. Jednakże okazuje się, że problem wyboru odpowiedniej współrzędnej reakcji jest nietrywialny, a bez tego nawet najdokładniej wyznaczone zmiany energii swobodnej nie wniosą nic do naszego zrozumienia tego typu procesów.
Pierwsze prace z zakresu asocjacji wykorzystywały US, co wymagało nałożenia dodatkowych potencjałów (ang. biasing potentials), których postać jest odgadywana przez osobę projektującą symulację. Stanowi to poważne ograniczenie metody, ponieważ nie istnieje systematyczne podejście, pozwalające przeprowadzać symulacje zjawisk asocjacji w sposób automatyczny.
Z pomocą przychodzą dwie, stosunkowo młode metody: ABF [5] oraz metadynamika [6], które eksplorują przestrzeń konfiguracyjną wzdłuż zadanego parametru porządku w sposób jednorodny (tzn. niezależnie od barier energetycznych). Publikacje [5,6] są też dobrym źródłem informacji na temat innych metod (głównie rozmaitych rozwinięć US) stosowanych w problemach asocjacji.
Energia swobodna solwatacji
Z powodu swej prostoty, obliczenia energii swobodnej solwatacji były jednymi z pierwszych prób wykorzystania metod FEP i TI [7,8]. Obecnie, energia swobodna solwatacji jest nadal ważna, bo służy jako pole do testów nowych metod obliczania energii swobodnej, do rozwijania nowych pól siłowych i w zagadnieniach praktycznych, gdy istotnie jest stwierdzenie, jak dany związek zachowuje się w różnych rozpuszczalnikach [9].
Zjawiska transportu
Zmiany energii swobodnej przekładają się również na własności złożonych kompleksów molekularnych, odpowiedzialnych za transport cząsteczek i jonów przez błonę komórkową. Ale zjawiska transportu dotyczą też translokacji rozpuszczalnika, antybiotyków, czy nawet białek (dokpóki odbywa się wymiana materii w poprzek błony). Zjawiska transportu mocno wiążą się z tematyką solwatacji, w szczególności gdy dochodzi do przejścia z jednego rozpuszczalnika (woda) do drugiego (lipidy błonowe). Jednak doświadczenia wyciągane z obliczeń energii swobodnej asocjacji znalazły swoje zastosowanie w zjawiskach transportu, bowiem łatwo zauważyć, że oś prostopadła do płaszczyzny błony stanowi doskonały parametr porządku [10].
Co ciekawe, zarówno w zjawiskach solwatacji, jak i transportu obserwuje się znaczące niedociągnięcia klasycznych potencjału stosowanych w dynamice molekularnej. Wynika to z addytywnego, parowego charakteru oddziaływań Lennarda-Jonesa i elektrostatycznych. W rzeczywistości, przy uwzględnieniu kwantowej natury układów atomowych, występują jeszcze efekty indukcyjne - gęstość elektronowa dostosowuje się na bieżąco do nowych konfiguracji, mocno wpływając na energię potencjalną oddziaływania. Z tego (i innych) powodu powstało polaryzowalne pole siłowe AMOEBA [11], które powoli zyskuje na popularności dzięki lepszej zgodności z eksperymentem (między innymi) w zjawiskach transportu.
Zwijanie i stabilność białek
Często proponowanym i ekscytującym frontem zastosowań metod obliczania energii swobodnej jest problem zwijania i stabilności białek. Stabilność może być badana zarówno eksperymentalnie jak i in silico poprzed punktowe podstawienia aminokwasów. Początkowe sukcesy (głównie za sprawą obliczeń Kollmana et al. [12,13]) obiecywały zaskakująco wysoką zgodność z eksperymentem, nawet przy zastosowaniu prostych modeli. Jednak bardziej złożone potencjały prowadziły do kompletnie innych wników, niż doświadczalne. Choć mogłoby się wydawać, że badanie różnić energii swobodnej w stanach zwiniętych jest uzasadnione w przypadkach, w których aminokwas wystawiony jest na rozpuszczalnik, to w istocie zgodność z eksperymentem okazywała się kwestią szczęścia [14]. Wniosek, jaki nasuwał się z tych pierwszych prac to ten, że chcąc badać wpływu substytucji na stabilność należy estymować nie tylko zmiany w energii swobodnej w stanach zwiniętych, ale również w stanach niezwiniętych.
Nagły upadek wykorzystania metod obliczania energii swobodnej, poprzedzony przez rozkwit i obietnice sukcesu jest dobrym przykładem na to jak ważne jest poprawne jej zastosowanie. W tym miejscu należy podać jako przykład pracy Hodela et al., w której badano wpływ izomeryzacji proliny (między stanami cis-trans) na stabilność nukleazy spotykanej u gronkowca [15]. Jest to przykład, w którym stan rozwinięty jest ten sam w obydwu przypadkach (izomeru cis i trans), zatem badanie różnic energii swobodnej w stanie zwiniętym jest uzasadnione. Ale podkreślmy, że jest to wyjątkowa sytuacja i zmiany energii swobodnej nie niosą żadnej informacji, jeżeli stan początkowy i stan końcowy nie są jednoznacznie określone, niezależnie od badanej tematyki.
Literatura
- Ligand-preceptor interactions, Comput. Chem. (1984), 8, 281--283. B. Tembe, J.A. McCammon.
- Frontiers in free-energy calculations of biological systems, WIREs Comput Mol Sci. (2014), 4, 71--89, C. Chipot.
- Standard Binding Free Energies from Computer Simulations: What is the Best Strategy, J. Chem. Theory Comput. (2012), 9, 794--802.
- Free energy calculations of protein-ligand interactions, Current opinion in chemical biology (2011), 15.4, 547--552.
- The adaptive biasing force method: everything you always wanted to know but were afraid to ask, J Phys Chem B. (2015), 119(3), 1129--1151, J. Comer, J.C. Gumbart, J. Hénin, T. Lelièvre, A. Pohorille, C. Chipot.
- Escaping free energy minima, Proc. Natl Acad. Sci. USA (2002), 99, 12562--12565, A. Laio, M. Parrinello.
- Free energy of hydrophobic hydration: A molecular dynamics study of noble gases in water, J. Chem. Phys. (1986), 85, 6720, T.P. Straatsma, H.J.C. Berendsen, J.P.M. Postma.
- Free energy calculation: applications to chemical and biochemical phenomena, Chem. Rev. (1993), 93, 2395--2417, P.A. Kollman.
- Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings, Adv. Drug Deliv. Rev. (1997), 23, 3--25, C.A. Lipinksi, F. Lombardo, B. Dominy, P.J. Feeney.
- Rational determination of transfer free energies of small drugs across the water-oil interface, J. Med. Chem (2002), 45, 151--159, D. Bas, D. Dorison-Duval, S. Moreau, P. Bruneau, C. Chipot.
- Polarizable Atomic Multipole-Based AMOEBA Force Field for Proteins, J. Chem. Theory Comput. (2013), 9, 4046--4063, Y. Shi, Z. Xia, J. Zhang, R. Best, C. Wu, J.W. Ponder, P. Ren
- Calculation of the relative change in binding free energy of a protein-inhibitor complex, Science (1987), 235, 574--576, P.A. Bash, U.C. Singh, F.K. Brown, R. Langridge, P.A. Kollman.
- Free-energy calculations on protein stability, J. Am. Chem. Soc. (1989), 111, 8505--8508, L.X. Dang, K.M. Merz, P.A. Kollman.
- Can the stability of protein mutants be preducted by free-energy calculations, Prot. Eng. (1993), 6, 289--295, Y.Y. Shi, A.E. Mark, C.X. Wang, F.H. Huang, H.J.C. Berendsen, W.F. van Gunsteren.
- Proline cis-trans isomerization in staphylococcal nuclease -- multi-substrate free-energy perturbation calculations, Prot. Sci. (1995), 4, 636-654, A. Hodel, L.M. Rice, T. Simonson, R.O. Fox, A.T, Brunger.