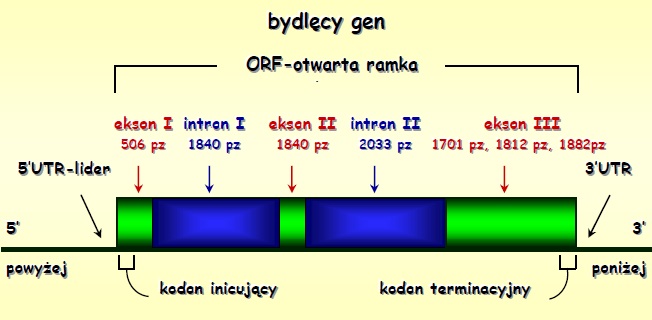
Miostatyna
Białko regulujące procesy wzrostu i różnicowania komórek mięśniowych. Kodowane przez gen zbudowany z trzech eksonów i dwóch intronów. Długość pierwszego eksonu wynosi 506 pz a drugiego eksonu 374 pz. Długość trzeciego eksonu jest zmienna i może wynosić 1701, 1812 lub 1887 nukleotydów; długość intronów to odpowiednio 1840 i 2033 pz. W eksonie pierwszym zlokalizowane jest miejsce inicjacji transkrypcji zlokalizowane 133 pz powyżej kodonu startu ATG. W rejonie 3’-UTR wykazano obecność trzech miejsc poliadenylacji, które są wykorzystywane in vivo. Schematyczna struktura genu miostatyny.
Miostatyna jest jednym z kluczowym genów odpowiedzialnych za rozwój mięśni szkieletowych. Wykazano, iż delecja 11 nukleutacje otydów w genie msn powoduje syntezę nieaktywnego biologicznie białka, w wyniku czego następuje rozrost mięśni i powstanie fenotypu określanego mianem tzw. „podwójnego umięśnienia”. Fenotyp ten jest szczególnie pożądany u bydła. Wykazano, iż fenotyp „podwójnego umięśnienia” u bydła rasy belgijskiej błękitnej charakteryzuje około 20% większa waga masy mięśniowej w porównaniu ze zwierzętami z dzikim wariantem genu miostatyny. Zwiększony rozrost mięsni wynika z hiperplazji mięśni szkieletowych, czyli większej liczby włókien mięśniowych a nie z ich przerostu. Obecnie znanych jest 9 mutacji w obrębie eksonów genu miostatyny, z czego 6 warunkuje skrajne formy hipertrofii mięśniowej a kolejne trzy mutacje są typu missnes.
Mutacje zlokalizowane w genie msn:
- F94L- zlokalizowana w eksonie I, prowadzi do zmiany fenyloalaniny na leucynę w pozycji 94 białka. Bez wpływu na aktywność miostatyny.
- S105C – zlokalizowana w wksonie I, poz. 314. Warunkuje zmianę cysteiny na serynę w pozycji 105 białka. Prowadzi do zaburzeń dimeryzacji ligandu, wpływa na obniżenie aktywności miostatyny.
- nt419 – zlokalizowana w eksonie 2. Delecja 7 nt, oraz insercja 10 nt. Skutkiem jest przedwczesne pojawienie się kodonu stop i zatrzymanie translacji w pozycji 139 białka. Powstałe białko jest nieaktywne biologicznie.
- D128N – zmiana kwasu asparaginowego na asparaginę
- Q204X – zlokalizowana w eksonie 2. Prowadzi do powstania kodonu stopu i zakończenia translacji w pozycji 203 białka.
- E226X - zlokalizowana w eksonie 2. Prowadzi do powstania kodonu stopu i zakończenia translacji w pozycji 225 białka.
- t821(del11) - zlokalizowana w eksonie 3. Delecja 11 nt powodująca powstanie kodonu stopu i syntezę skróconego, 273-aminokwasowego białka.
- C313Y – zlokalizowana w eksonie 3. Podstawienie jednej z 9 konserwatywnych cystein prowadzi do zmiany struktury III-rzędowej peptydu i utraty aktywności biologicznej białka.
- E291X - zlokalizowana w eksonie 3. Powodująca powstanie kodonu stopu i syntezę skróconego białka.
Miostatyna syntetyzowana jest w mięśniach jako propeptyd złozony z 376 aminokwasów. Białko zawiera sekwencję sygnałową, N-końcową domenę propeptydową oraz C-końcową domenę będącą aktywnym ligandem. Modyfikacja potranslacyjna miostatyny przebiega w kilku etapach. W pierwszym etapie na drodze proteolitycznego cięcia zostaje usunięty 24-aminokwasowy peptyd sygnałowy. Jego rolą jest przyłączenie białka do błony komórkowej tuż przed jego transportem poza komórkę. Następnie w wysoce konserwatywnym regionie pomiędzy 240-243 aminokwasem dochodzi do proteolitycznego rozszczepienia cząsteczki i połączenia dwóch podjednostek wiązaniem disiarczkowym, co prowadzi do powstania aktywnej formy peptydu. Schematyczna ilustracja aktywacji miostatyny jest przedstawiona na Rysunku 2.
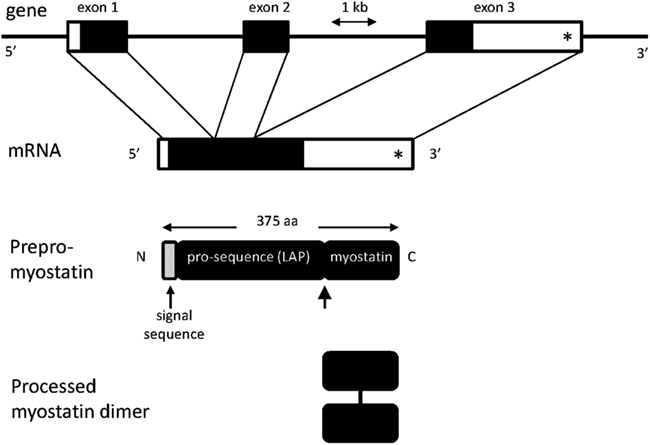
Nieaktywna postać miostatyny pełni także ważną funkcję w regulacji aktywności miostatyny. Propeptyd uczestniczy w procesie fałdowania, umożliwiając utworzenie prawidłowej struktury III rzędowej białka. Ponadto, poprzez tworzenie kompleksu z aktywnym homodimerem miostatyny blokuje jego aktywność. We włóknach mięśniowych miostatyna zlokalizowana jest w sarkoplazmie, tworząc niekiedy skupiska przylegające do błony komórkowej. Miostatyna wytwarzana przez włókna mięśniowe wykazuje aktywność autokrynną ale może być także wydzielana poza komórkę i trafiać zarówno do osocza krwi (działanie endokrynne), jak i do przylegających komórek satelitowych (działanie parakrynne), hamując ich proliferację i rożnicowanie. Szlak przekazywania sygnału indukowanego przez miostatynę nie został jeszcze dokładnie poznany. Udowodniono, że biologicznie aktywny homodimer miostatyny wiąże się do receptorow typu II dla aktywiny. Przyłączenie miostatyny do receptora indukuje fosforylację białek R-Smad (Smad-2 i Smad-3). Białko Smad-2/Smad-3 tworzy heterokompleksy z Co-Smad, z białkiem Smad-4, następnie poprzez oddziaływania z białkami wiążącymi się z DNA aktywuje zestaw genów docelowych. Uważa się, że sygnał pochodzący od miostatyny działa zarówno na białko p300/CBE jak i białka TGIF i c-Ski, które powodują zwiększenie aktywności deacetylazy histonów (HDAC) i prawdopodobnie w ten sposób hamują transkrypcję kilku genów odpowiedzialnych za wzrost włókien mięśniowych. Ilustrację przekaźnictwa sygnału indukowanego przez miostatynę przedstawia Rysunke 3.

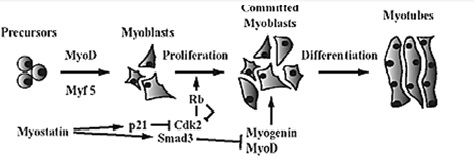
Miostatyna jest negatywnym regulatorem wzrostu mięśni szkieletowych, determinuje ostateczną liczbę włókien mięśniowych oraz wpływa na ich wielkość. Rola miostatyny jako głównego czynnika kontrolującego wzrost mięśni wynika z istotnej funkcji, jaką białko to pełni w procesie proliferacji i rożnicowania komórek mięśniowych. Aktywna miostatyna hamuje przechodzenie komórek z fazy G0 lub G1 cyklu komórkowego do fazy S poprzez zwiększanie ekspresji inhibitorów cyklino-zależnych kinaz: białek supresji nowotworowej p21, p27 i p53. Wymienione białka powodują z kolei obniżenie poziomu i zahamowanie aktywności cyklino-zależnej kinazy 2 (cdk-2), w wyniku czego dochodzi do hipofosforylacji białka Rb i zatrzymania mioblastów w fazie G1. Ponadto, miostatyna hamuje proces końcowego różnicowania mioblastów poprzez zmniejszenie poziomu lub zahamowanie aktywności czynników transkrypcyjnych z rodziny b-HLH (basic –Helix-Loop-Helix), MyoD, miogeninę, Myf-5 i Mrf-4. Dojrzały peptyd miostatyny, po modyfikacjach potranslacyjnych wiąże się do receptorów typu II (Act-RIIB lub Act-RIIA), receptor typu II aktywuje z kolei odpowiedni receptor typu I: ALK-4 (Act-RIB), bądź ALK-5 (Tβ-RI), co prowadzi do aktywacji wewnątrzkomórkowych przekaźników sygnału białek Smad. Ufosforylowany Smad-3 oddziałuje z domeną b-HLH MyoD, uniemożliwiając powstanie kompleksu aktywnego MyoD×cyklina E. Schematyczna ilustracja oddziaływania miostatyny na proliferację komórek mięśniowych jest przedstawiona na Rysunku 4.
Piśmiennictwo: