(→Kinaza mTOR) |
|||
| (Nie pokazano 73 pośrednich wersji utworzonych przez tego samego użytkownika) | |||
| Linia 1: | Linia 1: | ||
==Kinaza mTOR== | ==Kinaza mTOR== | ||
| − | '''mTOR''' (<u>m</u>echanistic <u>t</u>arget <u>o</u>f <u>r</u>apamycin, <u>m</u>ammalian <u>t</u>arget <u>o</u>f <u>r</u>apamycin) jest [[Kinazy białkowe|kinazą białkową]] serynowo-treoninową (EC 2.7.11.1) zdolną do wiązania kompleksu [[Rapamycyna|rapamycyny]] z białkiem FKBP12 (FK506-binding protein 12).{{r|Heitman et al. 1991}}{{r|Laplante and Sabatini 2009a}}{{r|Laplante and Sabatini 2012}} Stąd wywodzi się inna nazwa mTOR - '''FRAP1''' (<u>F</u>KBP12-<u>r</u>apamycin complex <u>a</u>ssociated <u>p</u>rotein 1). Należy do rodziny kinaz PIKK - kinaz spokrewnionych z kinazą fosfatydyloinozytolu (<u>p</u>hosphat<u>i</u>dylinositol 3-<u>k</u>inase-related <u>k</u>inase). Jest białkiem wielodomenowym o ciężarze cząsteczkowym 288.9 kDa. Od N-końca wyróżnić można następujące domeny: HEAT (Huntingtin-EF2-A subunit of PP2A-TOR1, aminokwasy 1-1512), FAT (FRAP-ATM-TRAP, 1513-1910), FRB (FKBP12 rapamycin binding, 2015-2114), domena kinazowa (2181-2431), NR (negative regulatory) oraz FATC (FRAP-ATM-TRAP C-terminal, 2517-2549). HEAT jest domeną zbudowaną z powtórzeń α-helis tworzących prawoskrętną superhelisę (jest to tzw. armdillo-like fold). Rozbudowana powierzchnia domeny HEAT umożliwia efektywne oddziaływanie z cząsteczkami | + | '''mTOR''' (<u>m</u>echanistic <u>t</u>arget <u>o</u>f <u>r</u>apamycin, <u>m</u>ammalian <u>t</u>arget <u>o</u>f <u>r</u>apamycin) jest [[Kinazy białkowe|kinazą białkową]] serynowo-treoninową (EC 2.7.11.1) zdolną do wiązania kompleksu [[Rapamycyna|rapamycyny]] z białkiem FKBP12 (FK506-binding protein 12).{{r|Heitman et al. 1991}}{{r|Laplante and Sabatini 2009a}}{{r|Laplante and Sabatini 2012}} Stąd wywodzi się inna nazwa mTOR - '''FRAP1''' (<u>F</u>KBP12-<u>r</u>apamycin complex <u>a</u>ssociated <u>p</u>rotein 1). Należy do rodziny kinaz PIKK - kinaz spokrewnionych z kinazą fosfatydyloinozytolu (<u>p</u>hosphat<u>i</u>dylinositol 3-<u>k</u>inase-related <u>k</u>inase). Jest białkiem wielodomenowym o ciężarze cząsteczkowym 288.9 kDa. Od N-końca wyróżnić można następujące domeny: HEAT (Huntingtin-EF2-A subunit of PP2A-TOR1, aminokwasy 1-1512), FAT (FRAP-ATM-TRAP, aminokwasy 1513-1910), FRB (FKBP12 rapamycin binding, aminokwasy 2015-2114), domena kinazowa (aminokwasy 2181-2431), NR (negative regulatory) oraz FATC (FRAP-ATM-TRAP C-terminal, aminokwasy 2517-2549). HEAT jest domeną zbudowaną z powtórzeń α-helis tworzących prawoskrętną superhelisę (jest to tzw. armdillo-like fold). Rozbudowana powierzchnia domeny HEAT umożliwia efektywne oddziaływanie z cząsteczkami białek i kwasów nukleinowych. Domena FRB tworzy α-helikalną strukturę wiążącą [[Rapamycyna|rapamycynę]]. Domena katalityczna kinazy mTOR jest funkcjonalną białkową kinazą serynowo/treoninową. Jej sekwencja wykazuje wysoki stopień podobieństwa do kinaz fosfatydyloinozytolu. |
| + | <!-- | ||
| + | <jmol> | ||
| + | <jmolApplet> | ||
| + | <uploadedFileContents>4JSN.pdb</uploadedFileContents> | ||
| + | </jmolApplet> | ||
| + | </jmol> | ||
| + | --> | ||
| + | Ostatnie badania biochemiczno-strukturalne{{r|Yang et al. 2013}} pozwalają wnioskować, iż mTOR wykazuje mechanizm katalityczny znacznie zbliżony do kanonicznych [[Kinazy białkowe|kinaz białkowych]]. Charakterystyczne dla tej kinazy jest to, że centrum aktywne znajduje się w zagłębieniu utworzonym przez domenę FRB, inhibitorową α-helisę domeny NR wystającą z centrum katalitycznego oraz białko mLST8. Regulacja aktywności mTOR opiera się o steryczną kontrolę dostępu substratów fosforylacji do szczeliny katalitycznej kinazy. Wiele z aktywujących mutacji kinazy mTOR lokuje się w rejonach ważnych dla stabilizacji powyższych struktur ograniczających dostęp do centrum aktywnego. Domena FRB działa jako ''gatekeeper'', oddziałując z substratami reakcji fosforylacji. | ||
{|class="wikitable floatright" style="text-align:center; margin: auto auto 1em 2em" border="1" | {|class="wikitable floatright" style="text-align:center; margin: auto auto 1em 2em" border="1" | ||
| Linia 10: | Linia 18: | ||
|colspan=2|mTOR | |colspan=2|mTOR | ||
|- | |- | ||
| − | |colspan=2| | + | |colspan=2|mLST8 |
|- | |- | ||
|colspan=2|DEPTOR | |colspan=2|DEPTOR | ||
| Linia 24: | Linia 32: | ||
|} | |} | ||
| − | Kinaza mTOR współtworzy w komórce dwa kompleksy białkowe o odmiennych funkcjach: '''TORC1''' oraz '''TORC2'''.{{r|Zheng et al. 1995}}{{r|Laplante and Sabatini 2009a}}{{r|Laplante and Sabatini 2012}} Jedynie pierwszy z nich jest hamowany przez [[Rapamycyna|rapamycynę]]. TORC1 integruje ścieżki sygnałowe kontrolujące wzrost, proliferację czy metabolizm komórki w odpowiedzi na sygnały pochodzące od hormonów, czynników wzrostu, składników odżywczych (aminokwasów), statutu energetycznego komórki | + | Kinaza mTOR współtworzy w komórce dwa kompleksy białkowe o odmiennych funkcjach: '''TORC1''' oraz '''TORC2'''.{{r|Zheng et al. 1995}}{{r|Laplante and Sabatini 2009a}}{{r|Laplante and Sabatini 2012}} Jedynie pierwszy z nich jest hamowany przez [[Rapamycyna|rapamycynę]]. TORC1 integruje ścieżki sygnałowe kontrolujące wzrost, proliferację czy metabolizm komórki w odpowiedzi na sygnały pochodzące od hormonów, czynników wzrostu, składników odżywczych (aminokwasów), statutu energetycznego komórki (AMP/ATP), a także stresów oksydacyjnego i genotoksycznego. Aktywacja kompleksu TORC1 polega na wyłączeniu jego negatywnego regulatora - heterodimeru '''TSC1-TSC2''' (hamartyna-tuberyna). Aktywny kompleks TSC1-TSC2 (TSC2 zawiera domenę GAP, GTPase activating protein) stymuluje aktywność GTPazową małej GTPazy RHEB. RHEB jest aktywatorem TORC1, ale tylko w formie związanej z GTP. Inhibicja kompleksu TSC1-TSC2 prowadzi zatem do włączenia funkcji białka RHEB aktywującej kompleks TORC1. TSC1-TSC2 może być hamowany w wyniku fosforylacji TSC2 przez osie sygnalne '''PI3K-AKT''' (phosphoinositide-3 kinase - protein kinase B) oraz '''ERK-RSK''' (extracellular signal regulated kinase - ribosomal S6 kinase). Natomiast w warunkach niskiego poziomu energetycznego komórki (wysokiej proporcji AMP/ATP) oraz hipoksji następuje aktywacja TSC1-TSC2 poprzez fosforylację TSC2 przez kinazy '''GSK3''' (glycogen synthase kinase 3) oraz '''AMPK''' (AMP-activated protein kinase). Aktywacja TORC1 przez aminokwasy wymaga przemieszczenia kompleksu do lizosomów, zależnego od GTPaz '''RAG''' (RRAGA, RRAGB, RRAGC, RRAGD). |
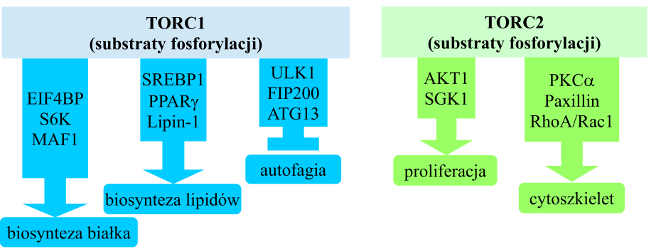
Najważniejsze procesy regulowane przez TORC1 to: | Najważniejsze procesy regulowane przez TORC1 to: | ||
| Linia 37: | Linia 45: | ||
| − | [[Image:mTOR-Rysunek2.png|thumb|center| | + | [[Image:mTOR-Rysunek2.png|thumb|center|650px|Schemat 1: Główne procesy komórkowe kontrolowane przez kompleksy kinazy mTOR]] |
| Linia 43: | Linia 51: | ||
'''Znaczenie kliniczne kinazy mTOR''' | '''Znaczenie kliniczne kinazy mTOR''' | ||
| − | Ścieżki sygnałowe, w które zaangażowana jest kinaza mTOR, kontrolują różnorakie procesy składające się na wzrost | + | Ścieżki sygnałowe, w które zaangażowana jest kinaza mTOR, kontrolują różnorakie procesy składające się na wzrost oraz proliferację komórek. Są to m.in.: angiogeneza, adipogeneza, aktywacja limfocytów T. Aktywacja ścieżek sygnalnych mTOR sprzyja rozwojowi nowotworów, chorób metabolicznych (np. cukrzyca typu 2), a także starzeniu. Rośnie zainteresowanie użyciem inhibitorów kinazy mTOR, a w szczególności analogów [[Rapamycyna|rapamycyny]] (rapalogów) jako leków. |
| − | Przy zbyt obfitej diecie organizm uruchamia mechanizmy, częściowo zależne od mTOR, które mają na celu gromadzenie składników odżywczych (na wypadek okresu ich | + | Przy zbyt obfitej diecie organizm uruchamia mechanizmy, częściowo zależne od mTOR, które mają na celu gromadzenie składników odżywczych (na wypadek okresu ich niedostatku). Może to prowadzić do otyłości czy chorób metabolicznych. TORC1 pośredniczy w aktywacji biosyntezy i akumulacji lipidów w adipocytach, a w konsekwencji stymuluje również rozrost tkanki tłuszczowej. Chroniczna hiperaktywacja TORC1 w otyłości powoduje nie tylko anormalną lipogenezę w tkance tłuszczowej, wątrobie i mięśniach, ale również insulinooporność. Mechanizm ten opiera się o negatywne sprzężenie zwrotne zależne od S6K oraz IRS1 prowadzące do wyłączenia ścieżki zależnej od receptora insuliny, a w konsekwencji spadku wychwytu glukozy, obniżenia poziomu glikogenezy i wzrostu poziomu glukoneogenezy w komórkach wątroby. To negatywne sprzężenie zwrotne zależne od S6K-IRS1 odgrywa znaczącą rolę w patogenezie hiperglikemii, hiperinsulinemii, a ostatecznie cukrzycy typu 2. |
| − | Mechanizmy zależne od aktywacji mTOR sprzyjają spontanicznemu rozwojowi nowotworów. | + | Mechanizmy zależne od aktywacji mTOR sprzyjają spontanicznemu rozwojowi nowotworów. Aktywowany przez TORC1 czynnik elongacyjny eIF4E stymuluje transkrypcję wielu pro-onkogenów, w tym regulatorów cyklu komórkowego czy białek anty-apoptotycznych (np. Mcl-1). Hamowanie autofagii w wyniku aktywacji mTOR również sprzyja rozwojowi chorób nowotworowych. TORC2 może również w sposób bezpośredni promować rozwój nowotworów poprzez aktywację kinaz z grupy AGC (AKT, SGK). Kinazy te promują proliferację, przeżycie komórki, a także wychwyt składników odżywczych. |
| − | Wiele dziedzicznych zespołów nowotworowych (np. stwardnienie guzowate), ma swoją genezę w mutacjach genów dla negatywnych regulatorów ścieżek zależnych od mTOR, jak np.: TSC1 (Tuberous Sclerosis 1), TSC2 (Tuberous Sclerosis 2), LKB1 (liver kinase B1, znany również jako STK11, Peutz-Jeghers syndrome), PTEN (phosphatase and tensin homolog deleted on chromosome ten, znany | + | Wiele dziedzicznych zespołów nowotworowych (np. stwardnienie guzowate), ma swoją genezę w mutacjach genów dla negatywnych regulatorów ścieżek zależnych od mTOR, jak np.: TSC1 (Tuberous Sclerosis 1), TSC2 (Tuberous Sclerosis 2), LKB1 (liver kinase B1, znany również jako STK11, Peutz-Jeghers syndrome), PTEN (phosphatase and tensin homolog deleted on chromosome ten, znany również jako MMAC1, mutated in multiple advanced cancers 1), NF1 (Neurofibromatosis) czy VHL (Von-Hippel Lindau). Onkogenne mutacje genów sieci sygnalnej PI3K-AKT, w sposób bezpośredni powiązanej z kompleksami TROC1 oraz TROC2, mogą również i często powodują rozwój nowotworów. |
| − | + | {|class="wikitable" style="text-align:center; border=1" | |
| − | + | |+Schematy ścieżek sygnalnych, w które zaangażowana jest kinaza mTOR | |
| − | + | !width=200px|[[File:mTOR-Rysunek3.png|thumb|100px|center|link=http://www.kegg.jp/kegg-bin/highlight_pathway?scale=1.0&map=hsa04150|źródło: baza KEGG]] | |
| − | + | !width=200px|[[File:mTOR-Rysunek4.gif|thumb|center|110px|link=http://jcs.biologists.org/content/122/20/3589/F1.poster.jpg|źródło: {{r|Laplante and Sabatini 2009a}}]] | |
| − | + | !width=200px|[[File:mTOR-Rysunek5.gif|thumb|center|100px|link=http://www.ncbi.nlm.nih.gov/core/lw/2.0/html/tileshop_pmc/tileshop_pmc_inline.html?title=Click%20on%20image%20to%20zoom&p=PMC3&id=3281571_cshperspect-SIG-011593_F2.jpg|źródło: {{r|Laplante and Sabatini 2012}}]] | |
| + | |} | ||
| + | |||
| Linia 70: | Linia 80: | ||
{{Przypisy-lista| | {{Przypisy-lista| | ||
| − | *<ref name="Heitman et al. 1991">{{ | + | *<ref name="Heitman et al. 1991">{{vcite journal |author=Heitman J, Movva NR, Hall MN |title=Targets for cell cycle arrest by the immunosuppressant rapamycin in yeast |journal=Science |volume=253 |issue=5022 |pages=905–9 |year=1991 |id= |doi= |url=http://www.sciencemag.org/content/253/5022/905}}</ref> |
| + | |||
| + | *<ref name="Laplante and Sabatini 2009a">{{vcite journal |author=Laplante M, Sabatini DM |title=mTOR signaling at a glance |journal=Journal of Cell Science |volume=122 |issue=20 |pages=3589-94 |year=2009 |id= |doi= |url=http://jcs.biologists.org/content/122/20/3589.short}}</ref> | ||
| − | *<ref name="Laplante and Sabatini | + | *<ref name="Laplante and Sabatini 2012">{{vcite journal |author=Laplante M, Sabatini DM |title=mTOR signaling |journal=Cold Spring Harbor Perspectives in Biology |volume=4 |issue=2 |pages=a011593 |year=2012 |id= |doi= |url=http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3281571/?report=reader#!po=50.0000}}</ref> |
| − | *<ref name=" | + | *<ref name="Zheng et al. 1995">{{vcite journal |author=Zheng XF, Florentino D, Chen J, Crabtree GR, Schreiber SL |title=TOR kinase domains are required for two distinct functions, only one of which is inhibited by rapamycin |journal=Cell |volume=82 |issue= |pages=121-130 |year=1995 |id=|doi=|url=http://www.cell.com/cell/abstract/0092-8674(95)90058-6}}</ref> |
| − | *<ref name=" | + | *<ref name="Ma and Blenis 2009">{{vcite journal |author=Ma XM, Blenis J |title=Molecular mechanisms of mTOR-mediated translational control |journal=Nature Reviews Molecular Cell Biology |volume=10 |issue=5 |pages=307-318 |year=2009 |id=|doi=|url=http://dx.doi.org/10.1038/nrm2672}}</ref> |
| − | *<ref name=" | + | *<ref name="Laplante and Sabatini 2009b">{{vcite journal |author=Laplante M, Sabatini DM |title=An emerging role of mTOR in lipid biosynthesis |journal=Current Biology |volume=19 |issue=22 |pages=R1046-R1052 |year=2009 |id=|doi=|url=http://www.cell.com/current-biology/abstract/S0960-9822(09)01771-0}}</ref> |
| − | *<ref name=" | + | *<ref name="Duvel et al. 2010">{{vcite journal |author=Duvel K, Yecies JL, Menon S, Raman P, Lipovsky AI, Souza AL, Triantafellow E, Ma Q, Gorski R, Cleaver S, Heiden MGV, MacKeigan JP, Finan PM, Clish CB, Murphyemail LO, Manningemail BD |title=Activation of a metabolic gene regulatory network downstream of mTOR complex 1 |journal=Current Biology |volume=39 |issue=2 |pages=171-183 |year=2010 |id=|doi=|url=http://www.cell.com/molecular-cell/abstract/S1097-2765(10)00463-6}}</ref> |
| − | *<ref name=" | + | *<ref name="Falcon et al. 2011">{{vcite journal |author=Falcon BL, Barr S, Gokhale PC, Chou J, Fogarty J, Depeille P, Miglarese M, Epstein DM, McDonald DM|title= Reduced VEGF production, angiogenesis, and vascular regrowth contribute to the antitumor properties of dual mTORC1/mTORC2 inhibitors|journal=Cancer Research|volume=71|issue=5|pages=1573-83|year=2011|id=|doi=|url=http://cancerres.aacrjournals.org/content/71/5/1573.abstract}}</ref> |
| − | *<ref name=" | + | *<ref name="Ganley et al. 2009">{{vcite journal |author=Ganley IG, Lam du H, Wang J, Ding X, Chen S, Jiang X|title=ULK1.ATG13.FIP200 complex mediates mTOR signaling and is essential for autophagy|journal=Journal of Biological Chemistry|volume=284|issue=18|pages=12297-305|year=2009|id=|doi=|url=http://www.jbc.org/content/284/18/12297.abstract}}</ref> |
| − | *<ref name=" | + | *<ref name="Settembre et al. 2012">{{vcite journal |author=Settembre C, Zoncu R, Medina DL, Vetrini F, Erdin S, Erdin S, Huynh T, Ferron M, Karsenty G, Vellard MC, Facchinetti V, Sabatini DM, Ballabio A|title=A lysosome-to-nucleus signalling mechanism senses and regulates the lysosome via mTOR and TFEB|journal=EMBO Journal|volume=31|issue=5|pages=1095-108|year=2012|id=|doi=|url=http://emboj.embopress.org/content/31/5/1095.abstract}}</ref> |
| − | *<ref name=" | + | *<ref name="Zoncu et al. 2011">{{vcite journal |author=Zoncu R, Efeyan A, Sabatini DM |title=mTOR: from growth signal integration to cancer, diabetes and ageing |journal=Nature Reviews. Molecular Cell Biology |volume=12|issue=1|pages=21-35|year=2011|id=|doi=|url=http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3390257}}</ref> |
| − | *<ref name=" | + | *<ref name="Yang et al. 2013">{{vcite journal |author=Yang H, Rudge DG, Koos JD, Vaidialingam B, Yang HJ, Pavletich NP |title=mTOR kinase structure, mechanism and regulation |journal=Nature |volume=497 |issue=7448 |pages=217-23 |year=2013 |id= |doi= |url=http://dx.doi.org/10.1038/nature12122}}</ref> |
}} | }} | ||
Aktualna wersja na dzień 10:19, 6 cze 2014
Kinaza mTOR
mTOR (mechanistic target of rapamycin, mammalian target of rapamycin) jest kinazą białkową serynowo-treoninową (EC 2.7.11.1) zdolną do wiązania kompleksu rapamycyny z białkiem FKBP12 (FK506-binding protein 12).[1][2][3] Stąd wywodzi się inna nazwa mTOR - FRAP1 (FKBP12-rapamycin complex associated protein 1). Należy do rodziny kinaz PIKK - kinaz spokrewnionych z kinazą fosfatydyloinozytolu (phosphatidylinositol 3-kinase-related kinase). Jest białkiem wielodomenowym o ciężarze cząsteczkowym 288.9 kDa. Od N-końca wyróżnić można następujące domeny: HEAT (Huntingtin-EF2-A subunit of PP2A-TOR1, aminokwasy 1-1512), FAT (FRAP-ATM-TRAP, aminokwasy 1513-1910), FRB (FKBP12 rapamycin binding, aminokwasy 2015-2114), domena kinazowa (aminokwasy 2181-2431), NR (negative regulatory) oraz FATC (FRAP-ATM-TRAP C-terminal, aminokwasy 2517-2549). HEAT jest domeną zbudowaną z powtórzeń α-helis tworzących prawoskrętną superhelisę (jest to tzw. armdillo-like fold). Rozbudowana powierzchnia domeny HEAT umożliwia efektywne oddziaływanie z cząsteczkami białek i kwasów nukleinowych. Domena FRB tworzy α-helikalną strukturę wiążącą rapamycynę. Domena katalityczna kinazy mTOR jest funkcjonalną białkową kinazą serynowo/treoninową. Jej sekwencja wykazuje wysoki stopień podobieństwa do kinaz fosfatydyloinozytolu. Ostatnie badania biochemiczno-strukturalne[4] pozwalają wnioskować, iż mTOR wykazuje mechanizm katalityczny znacznie zbliżony do kanonicznych kinaz białkowych. Charakterystyczne dla tej kinazy jest to, że centrum aktywne znajduje się w zagłębieniu utworzonym przez domenę FRB, inhibitorową α-helisę domeny NR wystającą z centrum katalitycznego oraz białko mLST8. Regulacja aktywności mTOR opiera się o steryczną kontrolę dostępu substratów fosforylacji do szczeliny katalitycznej kinazy. Wiele z aktywujących mutacji kinazy mTOR lokuje się w rejonach ważnych dla stabilizacji powyższych struktur ograniczających dostęp do centrum aktywnego. Domena FRB działa jako gatekeeper, oddziałując z substratami reakcji fosforylacji.
| TORC1 | TORC2 |
|---|---|
| mTOR | |
| mLST8 | |
| DEPTOR | |
| RAPTOR | RICTOR |
| PRAS40 | PROTOR1 |
| RHEB | mSIN1 |
Kinaza mTOR współtworzy w komórce dwa kompleksy białkowe o odmiennych funkcjach: TORC1 oraz TORC2.[5][2][3] Jedynie pierwszy z nich jest hamowany przez rapamycynę. TORC1 integruje ścieżki sygnałowe kontrolujące wzrost, proliferację czy metabolizm komórki w odpowiedzi na sygnały pochodzące od hormonów, czynników wzrostu, składników odżywczych (aminokwasów), statutu energetycznego komórki (AMP/ATP), a także stresów oksydacyjnego i genotoksycznego. Aktywacja kompleksu TORC1 polega na wyłączeniu jego negatywnego regulatora - heterodimeru TSC1-TSC2 (hamartyna-tuberyna). Aktywny kompleks TSC1-TSC2 (TSC2 zawiera domenę GAP, GTPase activating protein) stymuluje aktywność GTPazową małej GTPazy RHEB. RHEB jest aktywatorem TORC1, ale tylko w formie związanej z GTP. Inhibicja kompleksu TSC1-TSC2 prowadzi zatem do włączenia funkcji białka RHEB aktywującej kompleks TORC1. TSC1-TSC2 może być hamowany w wyniku fosforylacji TSC2 przez osie sygnalne PI3K-AKT (phosphoinositide-3 kinase - protein kinase B) oraz ERK-RSK (extracellular signal regulated kinase - ribosomal S6 kinase). Natomiast w warunkach niskiego poziomu energetycznego komórki (wysokiej proporcji AMP/ATP) oraz hipoksji następuje aktywacja TSC1-TSC2 poprzez fosforylację TSC2 przez kinazy GSK3 (glycogen synthase kinase 3) oraz AMPK (AMP-activated protein kinase). Aktywacja TORC1 przez aminokwasy wymaga przemieszczenia kompleksu do lizosomów, zależnego od GTPaz RAG (RRAGA, RRAGB, RRAGC, RRAGD).
Najważniejsze procesy regulowane przez TORC1 to:
- biosynteza białek - poprzez fosforylowanie takich regulatorów translacji, jak: 4E-BP1 (eukaryotic translation initiation factor 4E (eIF4E)-binding protein 1) oraz S6K1 (S6 kinase 1)[6];
- biosynteza lipidów - poprzez fosforylowanie czynników transkrypcyjnych SREBP1/2 (sterol regulatory element-binding protein 1/2) oraz PPARγ[7];
- produkcja ATP i ekspresja genów enzymów glikolitycznych - poprzez aktywację czynnika HIF1α[8];
- angiogeneza - poprzez aktywację HIF1α i ekspresję VEGF (vascular endothelial growth factor)[9];
- autofagia (regulacja negatywna) - poprzez fosforylowanie i supresję kompleksu ULK1/Atg13/FIP200 (unc-51-like kinase 1/mammalian autophagy-related gene 13/focal adhesion kinase family-interacting protein of 200 kDa)[10];
- tworzenie lizosomów - poprzez czynnik transkrypcyjny TFEB i ekspresję genów białek lizosomalnych[11].
TORC2 reguluje przeżycie komórki, metabolizm, a także organizację cytoszkieletu poprzez fosforylowanie takich kinaz z grupy AGC, jak: AKT, SGK1, PKCα.[2][12]
Znaczenie kliniczne kinazy mTOR
Ścieżki sygnałowe, w które zaangażowana jest kinaza mTOR, kontrolują różnorakie procesy składające się na wzrost oraz proliferację komórek. Są to m.in.: angiogeneza, adipogeneza, aktywacja limfocytów T. Aktywacja ścieżek sygnalnych mTOR sprzyja rozwojowi nowotworów, chorób metabolicznych (np. cukrzyca typu 2), a także starzeniu. Rośnie zainteresowanie użyciem inhibitorów kinazy mTOR, a w szczególności analogów rapamycyny (rapalogów) jako leków.
Przy zbyt obfitej diecie organizm uruchamia mechanizmy, częściowo zależne od mTOR, które mają na celu gromadzenie składników odżywczych (na wypadek okresu ich niedostatku). Może to prowadzić do otyłości czy chorób metabolicznych. TORC1 pośredniczy w aktywacji biosyntezy i akumulacji lipidów w adipocytach, a w konsekwencji stymuluje również rozrost tkanki tłuszczowej. Chroniczna hiperaktywacja TORC1 w otyłości powoduje nie tylko anormalną lipogenezę w tkance tłuszczowej, wątrobie i mięśniach, ale również insulinooporność. Mechanizm ten opiera się o negatywne sprzężenie zwrotne zależne od S6K oraz IRS1 prowadzące do wyłączenia ścieżki zależnej od receptora insuliny, a w konsekwencji spadku wychwytu glukozy, obniżenia poziomu glikogenezy i wzrostu poziomu glukoneogenezy w komórkach wątroby. To negatywne sprzężenie zwrotne zależne od S6K-IRS1 odgrywa znaczącą rolę w patogenezie hiperglikemii, hiperinsulinemii, a ostatecznie cukrzycy typu 2.
Mechanizmy zależne od aktywacji mTOR sprzyjają spontanicznemu rozwojowi nowotworów. Aktywowany przez TORC1 czynnik elongacyjny eIF4E stymuluje transkrypcję wielu pro-onkogenów, w tym regulatorów cyklu komórkowego czy białek anty-apoptotycznych (np. Mcl-1). Hamowanie autofagii w wyniku aktywacji mTOR również sprzyja rozwojowi chorób nowotworowych. TORC2 może również w sposób bezpośredni promować rozwój nowotworów poprzez aktywację kinaz z grupy AGC (AKT, SGK). Kinazy te promują proliferację, przeżycie komórki, a także wychwyt składników odżywczych.
Wiele dziedzicznych zespołów nowotworowych (np. stwardnienie guzowate), ma swoją genezę w mutacjach genów dla negatywnych regulatorów ścieżek zależnych od mTOR, jak np.: TSC1 (Tuberous Sclerosis 1), TSC2 (Tuberous Sclerosis 2), LKB1 (liver kinase B1, znany również jako STK11, Peutz-Jeghers syndrome), PTEN (phosphatase and tensin homolog deleted on chromosome ten, znany również jako MMAC1, mutated in multiple advanced cancers 1), NF1 (Neurofibromatosis) czy VHL (Von-Hippel Lindau). Onkogenne mutacje genów sieci sygnalnej PI3K-AKT, w sposób bezpośredni powiązanej z kompleksami TROC1 oraz TROC2, mogą również i często powodują rozwój nowotworów.
 źródło: [2] |
 źródło: [3] |
|---|
Zobacz też
- mOTR w bazie NCBI
- mTOR w bazie RCSB PDB
- mTOR w bazie GeneCards
- Atlas of Genetics and Cytogenetics in Oncology and Haematology
Literatura
- ↑ Heitman J, Movva NR, Hall MN. Targets for cell cycle arrest by the immunosuppressant rapamycin in yeast. Science. 1991;253(5022):905–9.
- ↑ 2,0 2,1 2,2 2,3 Laplante M, Sabatini DM. mTOR signaling at a glance. Journal of Cell Science. 2009;122(20):3589-94.
- ↑ 3,0 3,1 3,2 Laplante M, Sabatini DM. mTOR signaling. Cold Spring Harbor Perspectives in Biology. 2012;4(2):a011593.
- ↑ Yang H, Rudge DG, Koos JD, Vaidialingam B, Yang HJ, Pavletich NP. mTOR kinase structure, mechanism and regulation. Nature. 2013;497(7448):217-23.
- ↑ Zheng XF, Florentino D, Chen J, Crabtree GR, Schreiber SL. TOR kinase domains are required for two distinct functions, only one of which is inhibited by rapamycin. Cell. 1995;82:121-130.
- ↑ Ma XM, Blenis J. Molecular mechanisms of mTOR-mediated translational control. Nature Reviews Molecular Cell Biology. 2009;10(5):307-318.
- ↑ Laplante M, Sabatini DM. An emerging role of mTOR in lipid biosynthesis. Current Biology. 2009;19(22):R1046-R1052.
- ↑ Duvel K, Yecies JL, Menon S, Raman P, Lipovsky AI, Souza AL, Triantafellow E, Ma Q, Gorski R, Cleaver S, Heiden MGV, MacKeigan JP, Finan PM, Clish CB, Murphyemail LO, Manningemail BD. Activation of a metabolic gene regulatory network downstream of mTOR complex 1. Current Biology. 2010;39(2):171-183.
- ↑ Falcon BL, Barr S, Gokhale PC, Chou J, Fogarty J, Depeille P, Miglarese M, Epstein DM, McDonald DM. Reduced VEGF production, angiogenesis, and vascular regrowth contribute to the antitumor properties of dual mTORC1/mTORC2 inhibitors. Cancer Research. 2011;71(5):1573-83.
- ↑ Ganley IG, Lam du H, Wang J, Ding X, Chen S, Jiang X. ULK1.ATG13.FIP200 complex mediates mTOR signaling and is essential for autophagy. Journal of Biological Chemistry. 2009;284(18):12297-305.
- ↑ Settembre C, Zoncu R, Medina DL, Vetrini F, Erdin S, Erdin S, Huynh T, Ferron M, Karsenty G, Vellard MC, Facchinetti V, Sabatini DM, Ballabio A. A lysosome-to-nucleus signalling mechanism senses and regulates the lysosome via mTOR and TFEB. EMBO Journal. 2012;31(5):1095-108.
- ↑ Zoncu R, Efeyan A, Sabatini DM. mTOR: from growth signal integration to cancer, diabetes and ageing. Nature Reviews. Molecular Cell Biology. 2011;12(1):21-35.