(→Kinazy JAK) |
(→Kinazy JAK) |
||
| Linia 2: | Linia 2: | ||
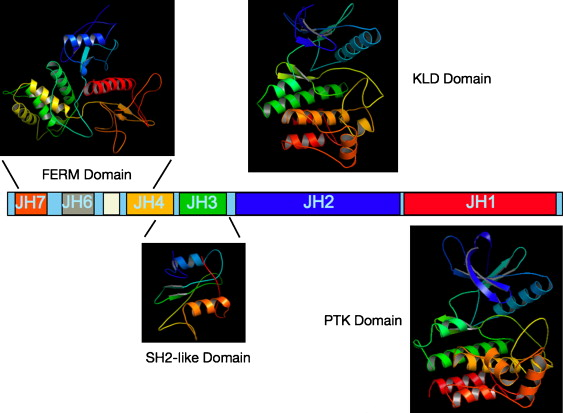
Kinazy JAK (<u>Ja</u>nus <u>K</u>inase) należą do rodziny eukariotycznych niereceptorowych tyrozynowych kinaz białkowych. Ludzkie kinazy JAK1 oraz JAK2 zostały odkryte przez Wilksa w 1989 roku (Wilks 1898), który zidentyfikował ich sekwencje kodujące w oparciu o tzw. zagnieżdżony PCR. Nowe kinazy zostały wtedy nazwane <u>J</u>ust <u>A</u>nother <u>K</u>inase. Do rodziny kinaz JAK należą również JAK3 oraz TYK2 (<u>Ty</u>rosine <u>K</u>inase 2). Kinazy JAK są białkami wielodomenowymi o ciężarze cząsteczkowym wynoszącym około 120-140 kDa. Ich budowę ilustruje Schemat 1. Sekwencja białek JAK została podzielona na siedem regionów homologii JH1-7 (JAK Homology) z początkiem na C-końcu białek JAK (Wilks 1991). Domena katalityczna ('''JH1''', o ciężarze cząsteczkowym około 40 kDa) znajduje się na C-końcu białka i jest funkcjonalną kinazą tyrozynową. Z domeną JH1 sąsiaduje tzw. domena pseudokinazowa '''JH2'''. Funkcja domeny JH2 polega na negatywnej regulacji aktywności katalitycznej domeny kinazowej. To właśnie te dwie sąsiadujęce ze sobą domeny zaispirowały nazwę kinaz JAK - kinazy Janusa. W starożytnej rzymskiej mitologii Janus był bożkiem początków i przejść, wrót i drzwi, o dwóch twarzach. W części N-końcowej białek JAK zostały zidentyfikowane jeszcze dwie domeny: trzecia '''FERM''' oraz czwarta '''SH2'''. Rola tych domen polega przede wszystkim na asocjacji i kotwiczeniu całego białka do cytoplazmatycznej cześci receptorów cytokin, czynników wzrostu oraz hormonów. | Kinazy JAK (<u>Ja</u>nus <u>K</u>inase) należą do rodziny eukariotycznych niereceptorowych tyrozynowych kinaz białkowych. Ludzkie kinazy JAK1 oraz JAK2 zostały odkryte przez Wilksa w 1989 roku (Wilks 1898), który zidentyfikował ich sekwencje kodujące w oparciu o tzw. zagnieżdżony PCR. Nowe kinazy zostały wtedy nazwane <u>J</u>ust <u>A</u>nother <u>K</u>inase. Do rodziny kinaz JAK należą również JAK3 oraz TYK2 (<u>Ty</u>rosine <u>K</u>inase 2). Kinazy JAK są białkami wielodomenowymi o ciężarze cząsteczkowym wynoszącym około 120-140 kDa. Ich budowę ilustruje Schemat 1. Sekwencja białek JAK została podzielona na siedem regionów homologii JH1-7 (JAK Homology) z początkiem na C-końcu białek JAK (Wilks 1991). Domena katalityczna ('''JH1''', o ciężarze cząsteczkowym około 40 kDa) znajduje się na C-końcu białka i jest funkcjonalną kinazą tyrozynową. Z domeną JH1 sąsiaduje tzw. domena pseudokinazowa '''JH2'''. Funkcja domeny JH2 polega na negatywnej regulacji aktywności katalitycznej domeny kinazowej. To właśnie te dwie sąsiadujęce ze sobą domeny zaispirowały nazwę kinaz JAK - kinazy Janusa. W starożytnej rzymskiej mitologii Janus był bożkiem początków i przejść, wrót i drzwi, o dwóch twarzach. W części N-końcowej białek JAK zostały zidentyfikowane jeszcze dwie domeny: trzecia '''FERM''' oraz czwarta '''SH2'''. Rola tych domen polega przede wszystkim na asocjacji i kotwiczeniu całego białka do cytoplazmatycznej cześci receptorów cytokin, czynników wzrostu oraz hormonów. | ||
| − | [[Image: JAK-Rysunek1.png|thumb|center| | + | [[Image: JAK-Rysunek1.png|thumb|center|800px|Schemat 1: Struktura domenowa kinaz JAK, PTK - Protein Tyrosine Kinase, KLD - Kinase-like Domain (żródło: A.F.Wilks ''Seminars in Cell & Developmental Biology'' 19(2008): 319-328)]] |
Wersja z 11:19, 8 maj 2014
Kinazy JAK
Kinazy JAK (Janus Kinase) należą do rodziny eukariotycznych niereceptorowych tyrozynowych kinaz białkowych. Ludzkie kinazy JAK1 oraz JAK2 zostały odkryte przez Wilksa w 1989 roku (Wilks 1898), który zidentyfikował ich sekwencje kodujące w oparciu o tzw. zagnieżdżony PCR. Nowe kinazy zostały wtedy nazwane Just Another Kinase. Do rodziny kinaz JAK należą również JAK3 oraz TYK2 (Tyrosine Kinase 2). Kinazy JAK są białkami wielodomenowymi o ciężarze cząsteczkowym wynoszącym około 120-140 kDa. Ich budowę ilustruje Schemat 1. Sekwencja białek JAK została podzielona na siedem regionów homologii JH1-7 (JAK Homology) z początkiem na C-końcu białek JAK (Wilks 1991). Domena katalityczna (JH1, o ciężarze cząsteczkowym około 40 kDa) znajduje się na C-końcu białka i jest funkcjonalną kinazą tyrozynową. Z domeną JH1 sąsiaduje tzw. domena pseudokinazowa JH2. Funkcja domeny JH2 polega na negatywnej regulacji aktywności katalitycznej domeny kinazowej. To właśnie te dwie sąsiadujęce ze sobą domeny zaispirowały nazwę kinaz JAK - kinazy Janusa. W starożytnej rzymskiej mitologii Janus był bożkiem początków i przejść, wrót i drzwi, o dwóch twarzach. W części N-końcowej białek JAK zostały zidentyfikowane jeszcze dwie domeny: trzecia FERM oraz czwarta SH2. Rola tych domen polega przede wszystkim na asocjacji i kotwiczeniu całego białka do cytoplazmatycznej cześci receptorów cytokin, czynników wzrostu oraz hormonów.