(Utworzył nową stronę „==Glutation== Glutation jest tripeptydem zbudowanym z reszt aminokwasowych kwasu glutaminowego, cysteiny i glicyny. Jest związakiem o właściwościach przeciwutlen...”) |
(→Glutation) |
||
| (Nie pokazano 1 pośredniej wersji utworzonej przez tego samego użytkownika) | |||
| Linia 2: | Linia 2: | ||
Glutation jest tripeptydem zbudowanym z reszt aminokwasowych kwasu glutaminowego, cysteiny i glicyny. Jest związakiem o właściwościach przeciwutleniających. Wzór strukturalny glutationu przedstawia rysunek 1. | Glutation jest tripeptydem zbudowanym z reszt aminokwasowych kwasu glutaminowego, cysteiny i glicyny. Jest związakiem o właściwościach przeciwutleniających. Wzór strukturalny glutationu przedstawia rysunek 1. | ||
| − | [[Image: | + | [[Image:glutation1.jpg|thumb|center|800px| Rysunek 1. Wzór strukturalny glutationu (źródło: http://bioinfo.mol.uj.edu.pl/articles/Karcz05).]] |
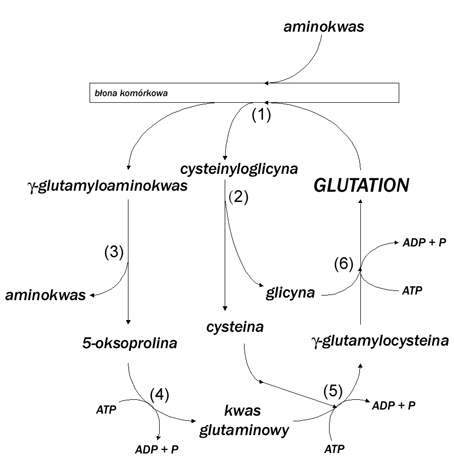
| − | Glutation jest obecny w komórkach ludzkiego organizmu. Największe jego stężenie znajduje się w komórkach wątroby i nerki. W komórkach 90 % glutationu zlokalizowane jest w cytoplazmie, 10 % w mitochondriach. Jest obecny także w płynach ustrojowych: osoczu, krwi i żółci. Glutation może być wytwarzany w organizmie z prekursorowych aminokwasów we wszystkich komórkach, jednak głównym miejscem jego syntezy jest wątroba, na terenie której odbywa się produkcja cysteiny z wykorzystaniem metioniny jako źródła siarki, w cyklu metioninowym. Glutation to jedyny peptyd, który nie jest syntetyzowany na matrycy mRNA. Synteza glutationu zachodzi w cytosolu i obejmuje dwie kolejne reakcje enzymatyczne, z których każda wymaga udziału energii w postaci ATP. Jest także peptydem odpornym na działanie peptydaz. Katabolizm glutationu zachodzi przy udziale enzymu | + | Glutation jest obecny w komórkach ludzkiego organizmu. Największe jego stężenie znajduje się w komórkach wątroby i nerki. W komórkach 90 % glutationu zlokalizowane jest w cytoplazmie, 10 % w mitochondriach. Jest obecny także w płynach ustrojowych: osoczu, krwi i żółci. Glutation może być wytwarzany w organizmie z prekursorowych aminokwasów we wszystkich komórkach, jednak głównym miejscem jego syntezy jest wątroba, na terenie której odbywa się produkcja cysteiny z wykorzystaniem metioniny jako źródła siarki, w cyklu metioninowym. Glutation to jedyny peptyd, który nie jest syntetyzowany na matrycy mRNA. Synteza glutationu zachodzi w cytosolu i obejmuje dwie kolejne reakcje enzymatyczne, z których każda wymaga udziału energii w postaci ATP. Jest także peptydem odpornym na działanie peptydaz. Katabolizm glutationu zachodzi przy udziale enzymu Y-glutamylotranspeptydazy i dipeptydaz. Szczególnie wysoka ich aktywność występuje w kanalikach nerkowych. Cykl syntezy i rozkładu glutationu przedstawia rysunek 2. |
| − | [[Image: | + | [[Image:glutation2.jpg|thumb|center|800px| Rysunek 2. Schematyczna ilustracja procesów syntezy i rozkładu glutationu (źródło: http://bioinfo.mol.uj.edu.pl/articles/Karcz05).]] |
Pełni on bowiem funkcję głównego wewnątrzkomórkowego czujnika stanu oksyredukcyjnego o dużej pojemności oraz funkcję „zmiatacza” reaktywnych związków elektrofilowych. Reakcje obu typów mogą zachodzić bez udziału enzymów, jednak w komórkach ssaków powszechnie występują enzymy katalizujące reakcje obu typów. Reaktywność glutationu uwarunkowana jest obecnością w jego cząsteczce grupy tiolowej. | Pełni on bowiem funkcję głównego wewnątrzkomórkowego czujnika stanu oksyredukcyjnego o dużej pojemności oraz funkcję „zmiatacza” reaktywnych związków elektrofilowych. Reakcje obu typów mogą zachodzić bez udziału enzymów, jednak w komórkach ssaków powszechnie występują enzymy katalizujące reakcje obu typów. Reaktywność glutationu uwarunkowana jest obecnością w jego cząsteczce grupy tiolowej. | ||
Aktualna wersja na dzień 14:32, 6 lis 2012
Glutation
Glutation jest tripeptydem zbudowanym z reszt aminokwasowych kwasu glutaminowego, cysteiny i glicyny. Jest związakiem o właściwościach przeciwutleniających. Wzór strukturalny glutationu przedstawia rysunek 1.
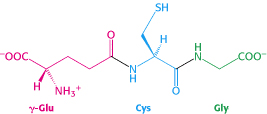
Glutation jest obecny w komórkach ludzkiego organizmu. Największe jego stężenie znajduje się w komórkach wątroby i nerki. W komórkach 90 % glutationu zlokalizowane jest w cytoplazmie, 10 % w mitochondriach. Jest obecny także w płynach ustrojowych: osoczu, krwi i żółci. Glutation może być wytwarzany w organizmie z prekursorowych aminokwasów we wszystkich komórkach, jednak głównym miejscem jego syntezy jest wątroba, na terenie której odbywa się produkcja cysteiny z wykorzystaniem metioniny jako źródła siarki, w cyklu metioninowym. Glutation to jedyny peptyd, który nie jest syntetyzowany na matrycy mRNA. Synteza glutationu zachodzi w cytosolu i obejmuje dwie kolejne reakcje enzymatyczne, z których każda wymaga udziału energii w postaci ATP. Jest także peptydem odpornym na działanie peptydaz. Katabolizm glutationu zachodzi przy udziale enzymu Y-glutamylotranspeptydazy i dipeptydaz. Szczególnie wysoka ich aktywność występuje w kanalikach nerkowych. Cykl syntezy i rozkładu glutationu przedstawia rysunek 2.
Pełni on bowiem funkcję głównego wewnątrzkomórkowego czujnika stanu oksyredukcyjnego o dużej pojemności oraz funkcję „zmiatacza” reaktywnych związków elektrofilowych. Reakcje obu typów mogą zachodzić bez udziału enzymów, jednak w komórkach ssaków powszechnie występują enzymy katalizujące reakcje obu typów. Reaktywność glutationu uwarunkowana jest obecnością w jego cząsteczce grupy tiolowej.
Literatura