| (Nie pokazano 8 pośrednich wersji utworzonych przez tego samego użytkownika) | |||
| Linia 4: | Linia 4: | ||
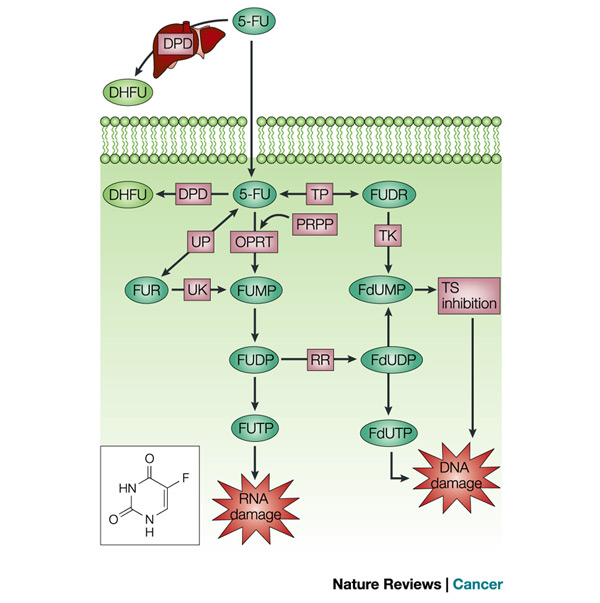
Metabolizm 5-FU we wnętrzu komórki jest dobrze poznany. Po wniknięciu do komórki ulega przekształceniu w 5-fluoro-2’-dezoksyurydynę (5-FFUdR) przy udziale fosforylazy tymidynowej. Następnie, przy działaniu kinazy tymidynowej, 5-FUdR ulega fosforylacji i powstaje monofosforan f-fluoro-2’-dezoksyurydyny (5-FdUMP), który jest aktywnym metabolitem 5-FU. 5-FU podlega jednoczesnemu metabolizmowi w dwóch szlakach komórkowych. Pierwszy z nich przekształca 5-FU do 5-FdUMP poprzez syntezę kolejnych związków: 5-fluorourydyny (5-FUR), przy udziale fosforylazy urydynowej, monofosforanu 5-fluorourydyny (5-FUMP), przy udziale kinazy urydnynowej oraz difosforanu 5-fluorourydyny (5-FUDP), który jest źródłem 5-FdUMP. Dodatkowo, 5-FUMP może być syntetyzowany bezpośrednio z 5-FU przy udziale fosforybozylotransferazy orotanowej. Ponadto 5-FUMP jest substratem do syntezy trifosforanu 5-fluorourydyny (5-FUTP). Również 5-FdUMP może być przekształcany do trifosforanu 5-fluoro-2’-dezoksyurydyny (5-FdUTP). Zarówno 5-FUTP jak i 5-FdUTP, oraz 5-FdUMP SA aktywnymi metabolitami 5-FU. Schematyczna ilustracja przemian 5-FU w komórce jest przedstawiona na rysunku 1. | Metabolizm 5-FU we wnętrzu komórki jest dobrze poznany. Po wniknięciu do komórki ulega przekształceniu w 5-fluoro-2’-dezoksyurydynę (5-FFUdR) przy udziale fosforylazy tymidynowej. Następnie, przy działaniu kinazy tymidynowej, 5-FUdR ulega fosforylacji i powstaje monofosforan f-fluoro-2’-dezoksyurydyny (5-FdUMP), który jest aktywnym metabolitem 5-FU. 5-FU podlega jednoczesnemu metabolizmowi w dwóch szlakach komórkowych. Pierwszy z nich przekształca 5-FU do 5-FdUMP poprzez syntezę kolejnych związków: 5-fluorourydyny (5-FUR), przy udziale fosforylazy urydynowej, monofosforanu 5-fluorourydyny (5-FUMP), przy udziale kinazy urydnynowej oraz difosforanu 5-fluorourydyny (5-FUDP), który jest źródłem 5-FdUMP. Dodatkowo, 5-FUMP może być syntetyzowany bezpośrednio z 5-FU przy udziale fosforybozylotransferazy orotanowej. Ponadto 5-FUMP jest substratem do syntezy trifosforanu 5-fluorourydyny (5-FUTP). Również 5-FdUMP może być przekształcany do trifosforanu 5-fluoro-2’-dezoksyurydyny (5-FdUTP). Zarówno 5-FUTP jak i 5-FdUTP, oraz 5-FdUMP SA aktywnymi metabolitami 5-FU. Schematyczna ilustracja przemian 5-FU w komórce jest przedstawiona na rysunku 1. | ||
| − | [[Image:nowy11.jpg|thumb|center|800px| Rysunek 1. Schematyczna ilustracja szlaków biochemicznych przezmian 5-FU w komórkach (źródło: http://www.nature.com/nrc/journal/v3/n5/fig_tab/nrc1074_F1.html) ]] | + | [[Image:nowy11.jpg|thumb|center|800px| Rysunek 1. Schematyczna ilustracja szlaków biochemicznych przezmian 5-FU w komórkach (źródło: http://www.nature.com/nrc/journal/v3/n5/fig_tab/nrc1074_F1.html).]] |
Cytotoksyczne oddziaływanie 5-FU jest związane z uszkodzeniem DNA. Punktem uchwytu w komórce jest hamowanie syntetazy tymidylowej TS. TS katalizuje syntezę 5’-monofosforanu-2’-dezoksytymidyny (dTMP) z 5’-monofosforanu-2’-dezoksyurydyny (dUMP). Pochodna 5-FU – 5-FdUMP łączy się z TS i kompetycyjnie uniemożliwia oddziaływanie enzymu z jego naturalnym substratem. Fosforylacja dTMP prowadzi do syntezy dTTP, który jest bezpośrednio wbudowywany do nowo powstających cząsteczek DNA. Niedobór TS powoduje zatrzymanie widełek replikacyjnych i niedokończenie powielenia informacji DNA. W konsekwencji cykl komórkowy zostaje zatrzymany w fazie S. Jeden z metabolitów 5-FU – 5-FdUTP może zastąpić dTTP i zostać wbudowany w syntetyzowane DNA. Jego obecność w DNA jest jednak odbierana przez komórkę jako nieprawidłowość wymagająca biochemicznej naprawy. Uaktywnieniu ulega glikozydaza uracylowa, która usuwa zasady azotowe z DNA. Jeżeli w strukturze DNA występuje kilka cząsteczek urydyny obok siebie, ich usunięcie powoduje utratę integralności DNA i pęknięcie. Poza DNA także RNA jest celem działania 5-FU. Działanie to dotyczy wszystkich rodzajów RNA: mRNA, tRNA, rRNA, nRNA, snRNA. Do syntetyzowanych cząsteczek RNA wbudowywany jest 5-FUTP. W wyniku takiej syntezy dochodzi do zmiany struktury drugorzędowej cząsteczek RNA, zaburzenia syntezy białek hamowania poliadenylacji mRNA, hamowania powstawania rRNA z cząsteczek nRNA, zmian struktury snRNA i zaburzenia wycinania intronów z mRNA i składania transkryptów. | Cytotoksyczne oddziaływanie 5-FU jest związane z uszkodzeniem DNA. Punktem uchwytu w komórce jest hamowanie syntetazy tymidylowej TS. TS katalizuje syntezę 5’-monofosforanu-2’-dezoksytymidyny (dTMP) z 5’-monofosforanu-2’-dezoksyurydyny (dUMP). Pochodna 5-FU – 5-FdUMP łączy się z TS i kompetycyjnie uniemożliwia oddziaływanie enzymu z jego naturalnym substratem. Fosforylacja dTMP prowadzi do syntezy dTTP, który jest bezpośrednio wbudowywany do nowo powstających cząsteczek DNA. Niedobór TS powoduje zatrzymanie widełek replikacyjnych i niedokończenie powielenia informacji DNA. W konsekwencji cykl komórkowy zostaje zatrzymany w fazie S. Jeden z metabolitów 5-FU – 5-FdUTP może zastąpić dTTP i zostać wbudowany w syntetyzowane DNA. Jego obecność w DNA jest jednak odbierana przez komórkę jako nieprawidłowość wymagająca biochemicznej naprawy. Uaktywnieniu ulega glikozydaza uracylowa, która usuwa zasady azotowe z DNA. Jeżeli w strukturze DNA występuje kilka cząsteczek urydyny obok siebie, ich usunięcie powoduje utratę integralności DNA i pęknięcie. Poza DNA także RNA jest celem działania 5-FU. Działanie to dotyczy wszystkich rodzajów RNA: mRNA, tRNA, rRNA, nRNA, snRNA. Do syntetyzowanych cząsteczek RNA wbudowywany jest 5-FUTP. W wyniku takiej syntezy dochodzi do zmiany struktury drugorzędowej cząsteczek RNA, zaburzenia syntezy białek hamowania poliadenylacji mRNA, hamowania powstawania rRNA z cząsteczek nRNA, zmian struktury snRNA i zaburzenia wycinania intronów z mRNA i składania transkryptów. | ||
| Linia 10: | Linia 10: | ||
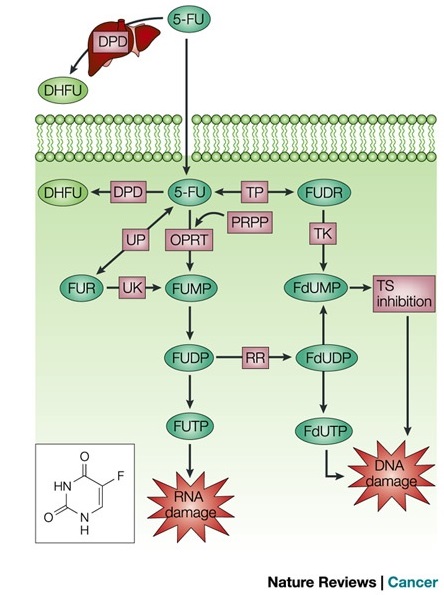
Obecnie stosowane są terapie łączone, które mają na celu zwiększenie cytotoksycznych efektów oddziaływania 5-FU. Leucovorin (LV) zwiększa wewnątrzkomórkową pulę 5,10-metylenotetrahydrofolianu, nasilając tym samym hamowanie aktywności TS prze FdUMP. Z kolei eniluracyl i uracyl blokują zależną dehydrogenazy dihydropirymidynowej (DPD) degradację 5-FU. Metotrexat (MTX) uważa się za czynnik stymulujący aktywność 5-FU poprzez zwiększenie aktywności 5-fosforybozylo-1-pirofosforanu (PRPP). Interferony stymulują działanie fosforylazy tymidynowej (TP) i nasilają powstawanie uszkodzeń DNA. Natomiast kapecytabina jest prekursorem 5-FU a jego podanie powoduje jego przekształcenie w 5-FU w wątrobie. Schematyczna ilustracja strategii wzmacniających działanie 5-FU jest przedstawiona na rysunku 2. | Obecnie stosowane są terapie łączone, które mają na celu zwiększenie cytotoksycznych efektów oddziaływania 5-FU. Leucovorin (LV) zwiększa wewnątrzkomórkową pulę 5,10-metylenotetrahydrofolianu, nasilając tym samym hamowanie aktywności TS prze FdUMP. Z kolei eniluracyl i uracyl blokują zależną dehydrogenazy dihydropirymidynowej (DPD) degradację 5-FU. Metotrexat (MTX) uważa się za czynnik stymulujący aktywność 5-FU poprzez zwiększenie aktywności 5-fosforybozylo-1-pirofosforanu (PRPP). Interferony stymulują działanie fosforylazy tymidynowej (TP) i nasilają powstawanie uszkodzeń DNA. Natomiast kapecytabina jest prekursorem 5-FU a jego podanie powoduje jego przekształcenie w 5-FU w wątrobie. Schematyczna ilustracja strategii wzmacniających działanie 5-FU jest przedstawiona na rysunku 2. | ||
| − | [[Image:flu22.jpg|thumb|center|800px| wzmacniania efektów cytotoksycznych 5-FU w terapii (źródło: http://www.nature.com/nrc/journal/v3/n5/fig_tab/nrc1074_F3.html) ]] | + | [[Image:flu22.jpg|thumb|center|800px| Rysunek 2. Strategie wzmacniania efektów cytotoksycznych 5-FU w terapii (źródło: http://www.nature.com/nrc/journal/v3/n5/fig_tab/nrc1074_F3.html).]] |
==Piśmiennictwo:== | ==Piśmiennictwo:== | ||
Aktualna wersja na dzień 10:36, 5 maj 2014
5-fluorouracyl
5-fluorouracyl (5-FU) to szeroko stosowany lek przeciwnowotworowy z grupy antymetabolitów. Wchodzi w skład programów wielolekowych lub jest elementem składowym chemioterapii. Do nowotworów leczonych z wykorzystaniem 5-FU należą nowotwór jelita grubego, odbytnicy, żołądka, przełyku, ponadto raka piersi, trzustki, głowy i szyi, nerki, prostaty, jajnika oraz w leczeniu rakowiaków. Działaniu 5-FU podlegają komórki syntetyzujące DNA a zwiększenie dawki leku koreluje proporcjonalnie ze wzrostem frakcji zabijanych komórek. Efekt działania 5-FU wynika ze złożonego mechanizmu działania 5-FU. Kluczowym mechanizmem jest blokowanie syntezy DNA poprzez hamowanie aktywności syntetazy tymidylowej ale także hamowanie wbudowywania metabolitów 5-FU do RNA i blokowanie tym samym syntezy białek. Ponadto, 5-FU generuje dużą ilość reaktywnych form tlenu (ROS), które indukują także śmierć komórek.
Metabolizm 5-FU we wnętrzu komórki jest dobrze poznany. Po wniknięciu do komórki ulega przekształceniu w 5-fluoro-2’-dezoksyurydynę (5-FFUdR) przy udziale fosforylazy tymidynowej. Następnie, przy działaniu kinazy tymidynowej, 5-FUdR ulega fosforylacji i powstaje monofosforan f-fluoro-2’-dezoksyurydyny (5-FdUMP), który jest aktywnym metabolitem 5-FU. 5-FU podlega jednoczesnemu metabolizmowi w dwóch szlakach komórkowych. Pierwszy z nich przekształca 5-FU do 5-FdUMP poprzez syntezę kolejnych związków: 5-fluorourydyny (5-FUR), przy udziale fosforylazy urydynowej, monofosforanu 5-fluorourydyny (5-FUMP), przy udziale kinazy urydnynowej oraz difosforanu 5-fluorourydyny (5-FUDP), który jest źródłem 5-FdUMP. Dodatkowo, 5-FUMP może być syntetyzowany bezpośrednio z 5-FU przy udziale fosforybozylotransferazy orotanowej. Ponadto 5-FUMP jest substratem do syntezy trifosforanu 5-fluorourydyny (5-FUTP). Również 5-FdUMP może być przekształcany do trifosforanu 5-fluoro-2’-dezoksyurydyny (5-FdUTP). Zarówno 5-FUTP jak i 5-FdUTP, oraz 5-FdUMP SA aktywnymi metabolitami 5-FU. Schematyczna ilustracja przemian 5-FU w komórce jest przedstawiona na rysunku 1.
Cytotoksyczne oddziaływanie 5-FU jest związane z uszkodzeniem DNA. Punktem uchwytu w komórce jest hamowanie syntetazy tymidylowej TS. TS katalizuje syntezę 5’-monofosforanu-2’-dezoksytymidyny (dTMP) z 5’-monofosforanu-2’-dezoksyurydyny (dUMP). Pochodna 5-FU – 5-FdUMP łączy się z TS i kompetycyjnie uniemożliwia oddziaływanie enzymu z jego naturalnym substratem. Fosforylacja dTMP prowadzi do syntezy dTTP, który jest bezpośrednio wbudowywany do nowo powstających cząsteczek DNA. Niedobór TS powoduje zatrzymanie widełek replikacyjnych i niedokończenie powielenia informacji DNA. W konsekwencji cykl komórkowy zostaje zatrzymany w fazie S. Jeden z metabolitów 5-FU – 5-FdUTP może zastąpić dTTP i zostać wbudowany w syntetyzowane DNA. Jego obecność w DNA jest jednak odbierana przez komórkę jako nieprawidłowość wymagająca biochemicznej naprawy. Uaktywnieniu ulega glikozydaza uracylowa, która usuwa zasady azotowe z DNA. Jeżeli w strukturze DNA występuje kilka cząsteczek urydyny obok siebie, ich usunięcie powoduje utratę integralności DNA i pęknięcie. Poza DNA także RNA jest celem działania 5-FU. Działanie to dotyczy wszystkich rodzajów RNA: mRNA, tRNA, rRNA, nRNA, snRNA. Do syntetyzowanych cząsteczek RNA wbudowywany jest 5-FUTP. W wyniku takiej syntezy dochodzi do zmiany struktury drugorzędowej cząsteczek RNA, zaburzenia syntezy białek hamowania poliadenylacji mRNA, hamowania powstawania rRNA z cząsteczek nRNA, zmian struktury snRNA i zaburzenia wycinania intronów z mRNA i składania transkryptów.
Obecnie stosowane są terapie łączone, które mają na celu zwiększenie cytotoksycznych efektów oddziaływania 5-FU. Leucovorin (LV) zwiększa wewnątrzkomórkową pulę 5,10-metylenotetrahydrofolianu, nasilając tym samym hamowanie aktywności TS prze FdUMP. Z kolei eniluracyl i uracyl blokują zależną dehydrogenazy dihydropirymidynowej (DPD) degradację 5-FU. Metotrexat (MTX) uważa się za czynnik stymulujący aktywność 5-FU poprzez zwiększenie aktywności 5-fosforybozylo-1-pirofosforanu (PRPP). Interferony stymulują działanie fosforylazy tymidynowej (TP) i nasilają powstawanie uszkodzeń DNA. Natomiast kapecytabina jest prekursorem 5-FU a jego podanie powoduje jego przekształcenie w 5-FU w wątrobie. Schematyczna ilustracja strategii wzmacniających działanie 5-FU jest przedstawiona na rysunku 2.